Sarkoidose - Faglige retningslinjer for sarkoidose
Kliniske manifestasjoner
Hjerte
Sist faglig oppdatert: 15.05.2022
Peder Sörensson, Susanna Kullberg, Per Eldhagen, Olov Andersson, Pernilla Darlington og Anders Eklund
Innledning
Til tross for at sarkoidose i hjertet ble beskrevet for mer enn 80 år siden, utgjør tilstanden fremdeles en diagnostisk og behandlingsmessig utfordring. Det har sammenheng med at det i noen tilfeller bare foreligger enkelte granulomer i myokardiet, mens det i andre tilfeller foreligger en utbredt granulomatøs betennelse med uttalte rytmeforstyrrelser og hjertesvikt. Sarkoidose i hjertet kan utgjøre det første tegnet på sykdommen. I obduksjonsmaterialer av pasienter med sarkoidose, er det rapportert at ikke nekrotiserende epiteloidcellegranulomer finnes i hjertet hos nærmere 25 % av pasientene. Andelen pasienter med klinisk påvist hjerte- engasjement har hittil kun utgjort cirka 5 %. I studier er det rapportert at 40-65 % av alle med hjertesarkoidose har sykdommen kun i dette organet.
Sarkoidose kan involvere alle deler av hjertet, men prognosen er relatert til lokalisasjon og utbedring av forandringene. Granulomavleiring i myokardiet kan lede til hypertrofi med en mer eller mindre utbredt fibrose. En sekvens med initial betennelse, etterfulgt av granulomdannelse og fibrotisering med postinflammatorisk arrdannelse, er en sannsynlig sykdomsutvikling. Av uklar årsak er ledningssystemet ofte engasjert ved hjertesakoidose.
Granulomdannelse kan som grunnlregel forekomme i alle deler av hjertet, men klaffeapparatet og kransarteriene er sjelden direkte engasjert. Også perikard kan involveres, og perikardvæske sees hos 5- 15 %. Det er rapportert vesentlig hyppigere forekomst av hjertesarkoidose i noen populasjoner (for eksempel den japanske) enn i andre etniske grupper. I senere år har man rapportert en betydelig økning av antallet tilfeller; sannsynligvis beror dette hovedsakelig på forbedrede diagnostiske metoder. Ettersom tilstanden er potensielt alvorlig, er diskrepansen mellom påvist og faktisk forekomst av hjertesarkoidose altfor stor. Derfor er det viktig at diagnostikken blir bedre, og at det utarbeides rutiner for å nå dette målet lettere. Ejeksjonsfraksjonen i venstre ventrikkel (LVEF) utgjør en vesentlig prediktiv indikasjon på sykdommens alvorlighetsgrad. Moderne bildeframstillingsteknikker som MR (magnetresonansteknikk) og FDG-PET/ (18-fluorodeoxyglukose-positron-emisjonstomografi) gir, om de utnyttes rett, nye og bedre diagnostiske forutsetninger. Dette er vesentlig, da histologisk verifikasjon ofte mangler, og forandringene i hjertet kan være de eneste tegnene på sarkoidose. Disse bildeframstillingsteknikkene skaper også muligheter til å monitorere terapeutiske tiltak sikrere, tiltak som fortsatt er mangelfullt validitert. Det foreligger altså en betydelig interesse for bedre å kunne identifisere terapier som kan redusere morbiditet og mortalitet.
Klinisk bilde
To hovedscenarier kan foreligge. I det ene får en pasient med sarkoidose i andre organer symptomer eller tegn på kardiell sykdom. Det andre scenarioet er en pasient som uten tegn på sarkoidose i andre organer, utvikler symptomer relatert til for eksempel ledningshinder, ventrikkelarytmier eller kardiell dysfunksjon. Hjerteengasjement kan sannsynliggjøres eller bekreftes med tilgjengelige teknikker som EKG, ekkokardiografi, MR og FDG-PET/CT.
Hyppig rapporterte symptomer er palpitasjoner, svimmelhet og/eller besvimelse. Dette beror vanligvis på arytmier, som i verste fall kan forårsake plutselig død. Tegn på hjertesvikt kan også være sarkoidoserelatert. Dersom hjertesarkoidose foreligger, har symptomer relatert til ekstrakardielle sarkoidoseforandringer, ifølge rapporter vært mildere, da disse organengasjementene da ikke pleier å være så uttalt.
Hjertesarkoidose kan forårsake små, flekkvise forandringer basalt i hjertet, som ikke medfører noen kliniske symptomer. Dersom ulike grader av blokkering forekommer, sees derimot ikke sjelden større områder med sarkoidoseforårsakede forandringer i septum. Hvis også større områder i ventriklene er blitt engasjert, kan pasienten utvikle hjertesvikt med eller uten blokkering, eller ventrikkelarytmi.
Utredning og diagnostikk
Røntgen thorax
Konvensjonell røntgen thorax skal gjøres ved mistanke om kardiell sarkoidose. CT thorax er også ofte motivert.
Hvile- EKG
Hvile- EKG med 12 avdelinger skal tas rutinemessig på alle pasienter som utredes med mistanke om sarkoidose, uansett om symptomer som leder tankene til hjerteengasjement foreligger eller ikke. EKG bør gjentas om det senere i sykdomsforløpet tilkommer kliniske tegn på hjertetpåvirkning. EKG- forandringer er betydelig vanligere hos pasienter med hjertesarkoidose enn hos kontroller. Det foreligger en høyere insidens av grenblokk, AV- blokk, sinusbradykardi, atrie- og ventrikkelektopiske slag, og dessuten av patologiske Q-bølger og uspesifikke STT- forandringer, hos pasienter med sarkoidose. Det bør likevel bemerkes at EKG- forandringene ikke er spesifikke for sarkoidose. En helt normalt EKG hos en pasient med sarkoidose, uten kardielle symptomer, utelukker derimot langt på vei et klinisk relevant hjerteengasjement.
Derimot bør en pasient som har rapportert symptomer forenlige med hjertesarkoidose utredes videre, selv om hvile-EKG er normalt.
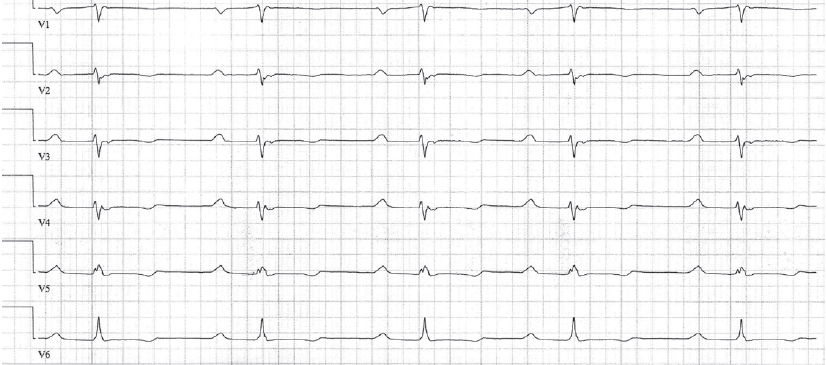
Langtids-EKG
Kan gi verdifull informasjon om rytmeforstyrrelser (atrieflimmer, supraventrikulære/ventrikulære takykardier) og antallet SVES og VES.
Ekkokardiografi
Dersom det ikke foreligger noen kliniske symptomer, er undersøkelsen ofte normal. Derimot kan den, ved manifestert hjertesarkoidose gi verdifull informasjon om ventrikkeldysfunksjon, økt eller minsket veggtykkelse. Sistnevnte er gjerne lokalisert basalt, og i sjeldne tilfeller utvikles aneurysme. Fortykkelsen av veggene kan ligne den som ses ved hypertrofisk kardiomyopati. Fordeler med metoden er at den er ikke- invasiv, at den ikke gir noen strålebelastning, samt at den er forholdsvis billig og lett kan gjentas. Denne utgjør også et bra alternativ eller suppliment ved oppfølging under pågående behandling
Arbeids-EKG
Kan gi verdifull informasjon om rytmeforstyrrelser (atrieflimmer, supraventrikulære/ventrikulære takykardier) og antallet SVES og VES.
MR
Magnetresonans-teknikken har vist seg å være meget verdifull i diagnostikken av hjertesarkoidose. Metoden innebærer ingen strålebelastning for pasienten, den er ikke invasiv, og gir meget valide data for volum og funksjon av henholdsvis venstre og høyre ventrikkel. Introduksjonen av det ekstracellulære kontrastmiddelet gadolinium har revolusjonert de diagnostiske mulighetene med MR. LGE (late gadolinium enhancement) brukes nå alltid ved utredning av suspekt hjertesarkoidose. Metoden kan avsløre fibrotiske og aktive inflammatoriske forandringer, som ofte finnes i venstre ventrikkelseptum og lateralveggen, og også differensiere mellom dem. Nå for tiden brukes også ulike mapping-teknikker for å finne tilsvarende funn. Forandringene er likevel ikke helt spesifikke for hjertesarkoidose, men man tolker LGE- mønster ut fra lokalisasjon og utbredning i ventrikkelen, og hvorvidt forandringene er av ischemisk eller ikke-ischemisk karakter. De vanligst forekommende forandringene er flere små flekker med LGE midtmuralt eller epikardielt i venstre kammer. En annen stor fordel med MR-teknikken, er at den enkelt kan gjentas ved for eksempel monitorering av effekten av innsatt behandling. Teknikkutvikling pågår for å kombinere PET og MR i den hensikt å bedre kunne belyse såvel inflammasjons- som fibroseinnslag.
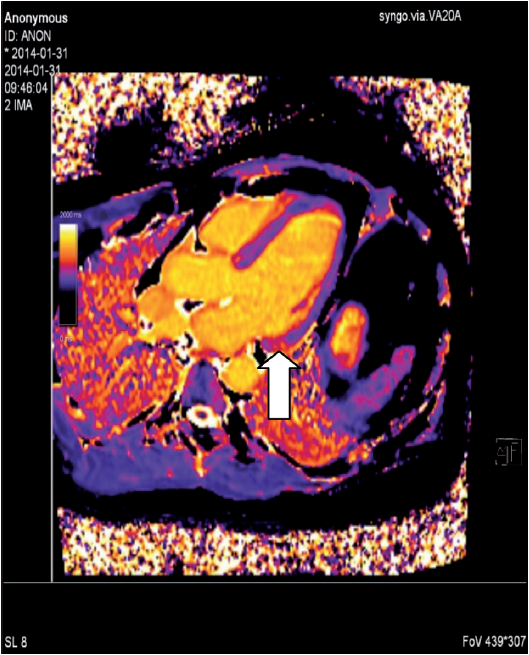
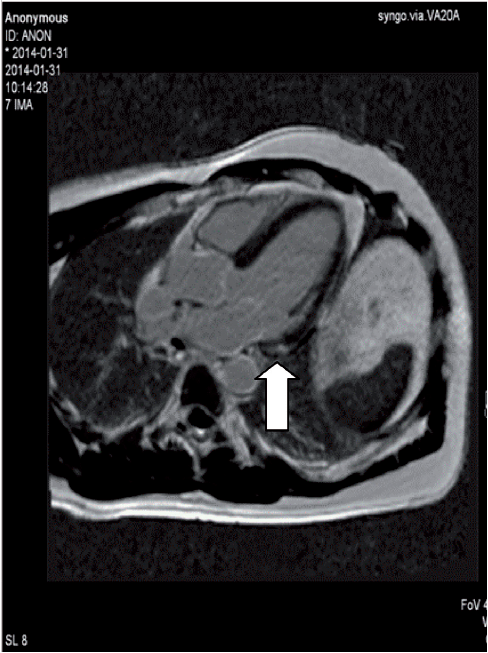
MR: Lett kardiell sarkoidose (ødem + LGE basalt inferolateralt).
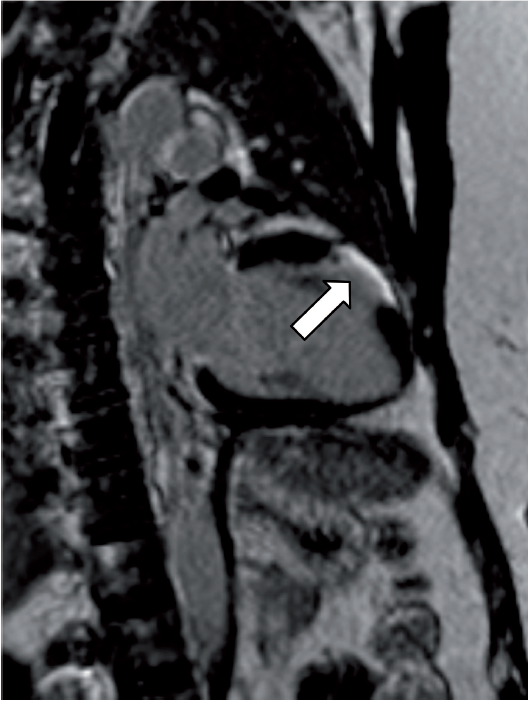
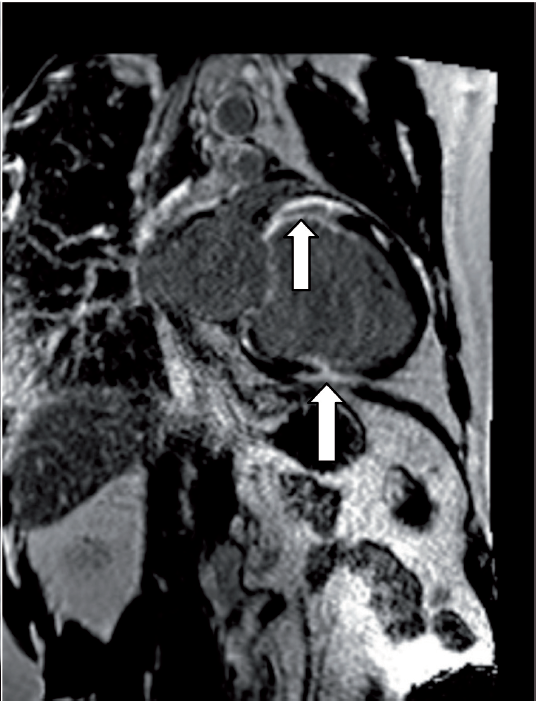
Mer uttalte fibroseforandringer hos to pasienter med hjertesarkoidose (venstre: fokalt midtventrikulært anteriort; høyre: i flere segmenter basalt og midtventrikulært anteriort og inferiort).
FDG-PET/CT
Noen anbefaler FDG-PET/CT for å påvise inflammatoriske forandringer, da FDG er en glukoseanalog, som kan gjenspeile økt glukosemetabolisme i inflammatoriske områder. Et problem er at den naturlige glukosemetabolismen kan gi et relativt stort fysiologisk opptak i hjertet, og derved komplisere tolkningen. Derfor er det utarbeidet skjemaer for å la pasientene «sulte» en kortere tid før undersøkelsen, i den hensikt å minske bakgrunnseffekten. Et annet problem utgjør den ganske høye strålebelastningen, som medfører at gjentatte PET- undersøkelser ikke kan anbefales. En enkelt undersøkelse kan likevel være verdifull, ved at også tidligere ukjente ekstrakardielle forandringer, f eks i lymfeknuter, kan oppdages, og utgjøre nye diagnostiske biopsimuligheter.
Noen anbefaler at MR utføres først ved mistanke om hjertesarkoidose, og at FDG-PET/CT tas deretter, både for å bekrefte diagnosen og for å styrke indikasjonen for behandling av inflammatoriske forandringer. FDG-PET/CT kan videre være et verdifullt alternativ dersom MR av en eller annen grunn er kontraindisert.
Myokardbiopsier
Metoden er invasiv, og har ganske lav treffsikkerhet, på grunn av at granulomer/fibrose som regel bare finnes flekkvis, og for det meste i venstre ventrikkel. Dersom elektrofysiologisk mapping eller billedstyring (MR eller PET) brukes som veiledning, kan det positive utfallet ved hjertebiopsier øke fra 10-20% til opp mot 50%.
Biomarkører
ACE
Aktiviteten i serum av dette enzymet, som aktiverer angiotensin I til II, har lenge vært brukt som en markør for aktivitet ved sarkoidose. En høy verdi indikerer økt granulommasse og/eller aktivitet, men relaterer ganske dårlig til andre utfallsparametre som røntgen thorax og lungefunksjon. ACE-verdien synker under kortisonbehandling, og normaliseres av ACE-hemmere. Økt ACE- aktivitet er ikke heller helt spesifikk for sarkoidose, men kan ses ved for eksempel silikoner, tbc og allergisk alveolitt.
Troponin
En skade på myokardiets muskelceller kan, uansett årsak, resultere i forhøyde nivåer av høysensitivt troponin (hs-troponin T/I) i blodet. I en finsk undersøkelse studerte man troponinnivåer ved nydiagnostisert hjertesarkoidose, og man kunne konstatere at de økte nivåene man kunne påvise hos noen pasienter, i mange tilfeller falt raskt under prednisolonbehandling. Det framkom tegn på en sammenheng mellom forhøyede troponinnivåer og økt risiko for alvorlige konsekvenser senere i forløpet. Tolkningen av forekomsten av økte nivåer av troponin kan imidlertid kompliseres av at troponinlekkasje lett oppstår av flere ikke sarkoidoserelatrerte årsaker.
BNP og pro-BNP
BNP (brain natriuretic peptide) er et hormon som utskilles na- turlig fra hjertet ved belastning og strekning, og har en væske- drivende virkning. Det dannes først som et prohormon, som siden spaltes i to deler: Det aktive hormonet BNP, og den hor- monelt inaktive N-terminalen av molekylet, NT-proBNP. Dette har en lengre halveringstid. Nivåene av peptidene korrelerer godt til graden av hjertesvikt. Lave verdiene taler sterkt imot hjertesvikt (f.eks. NT-proBNP < 125 ng/l), mens høye verdier taler for at hjertesvikt foreligger. Ved hjertesarkoidose har det vist seg at forhøyde verdier av NT-proBNP ofte forekommer.
Øvrige aktivitetsmarkører
En rekke andre markører som kunne tenkes å gjenspeile aktiv sarkoidosesykdom har vært testet ut, uten at man har kunnet vise noen overbevisende, klinisk brukbar sammenheng. Det gjelder bl.a. beta2~mikroglobulin, fibronektin og vitronektin. En aktuell markør er IL-2R, som secerneres TH- type 1-celler, og som man antar spiller en vesentlig rolle ved sarkoidose ved å stimulere T-celleproliferasjon. Løselig IL-2R kan måles i se- rum, det er rapportert å kunne reflektere sarkoidose-aktivitet. Anvendeligheten ved aktivitetsvurdering av hjertesarkoidose er imidlertid fortsatt usikker. Det samme gjelder neoprerin, som er en prekursor til biopterin. Dette utgjør på sin side en kofaktor i nevrotransmittersyntesen. Ved sarkoidose er neopterin ansett som interessant når det gjelder aktivitet. Det har vist seg at dette utskilles når monocytter i kultur stimuleres av aktiverte T-celler, bl.a. ved at IFN-gamma utskilles.
To veier til diagnostikk av hjertsarkoidose:
Diagnosen er sannsynlig dersom (A) det foreligger histologiske funn av ekstrakardiell sarkoidose
OG LVEF – left ventricular ejection fraction; LGE – late gadolinium enhancement |
Konsensusanbefalinger for diagnostiske kriterier for hjertesarkoidose (modifisert etter Birnie et al. 2014).
Behandling
Allment
Å stille diagnosen hjertesarkoidose med sikkerhet er vanskelig. Ofte er behandling motivert uten at histologisk bevis på granulomer foreligger. I fravær av helbredende behandling ved sarkoidose, blir symptomlindrende behandling viktig. Betablokker er førstevalg ved såvel supraventrikulære som ventrikulære arytmier. Amiodaron kan prøves i akutte situasjoner med ventrikkeltakykardi. Klasse I antiarrytmika (f.eks. disopyramid, flekainid) anbefales ikke, da mange kan ha myokardielle arr.
Ved hjertesvikt forårsaket av sarkoidose, skal det gis behandling med konvensjonelle legemidler som ACE- hemmere (ACE-I), angiotensinreseptorblokkere (ARB), betablokkere, og eventuelt mineralkortikoidreseptorblokkere (MRA). Evidensen for effekt er muligens noe høyere for ACE-I sammenlignet med ARB, men ACE-I gjør på den annen side oppfølging med måling av ACE- aktiviteten i serum meningsløs. Evaluering og opptitrering gjøres i henhold til gjeldende allmenne anbefalinger ved behandling av hjertesvikt.
Immunsuppresjon
Den terapien som oftest brukes initialt er kortikosteroider, til tross for at den vitenskapelige dokumentasjonen for positiv effekt er begrenset, og helt basert på retrospektive studier. Det finnes ingen klar konsensus om hvorvidt alle skal behandles, eller bare de med symptomer eller klare tegn på inflammasjon. De best undersøkte effektene er påvirkning på AV- overledning og venstre ventrikkelfunksjon. Omtrent halvparten av alle som har fått behandling, har i metaanalyser vist seg å få forbedret overledning, mens effekten på venstre ventrikkels funksjon synes å være avhengig av graden av påvirkning når behandlingen påbegynnes. Best effekt er rapportert hos pasienter med ventrikkelfunksjon i området normal til moderat påvirket ved behandlingsstart, men det foreligger også en rapport om effekt ved alvorlig funksjonspåvirkning. Det ser ikke ut til at langtidsutfallet påvirkes av dosen prednisolon når behandlingen påbegynnes, og ikke heller av tidspunkt for behandlingsoppstart i forhold til sykdomsdebuten.
Immunsuppresjon bør overveies dersom det er tegn på inflammasjon ved:
- AV- blokk II eller AV- blokk III
- med ektopiske VES eller kort selvterminerende ventrikulær arytmi
- ikke selvterminerende ventrikulær arytmi
- dysfunksjon av venstre ventrikkel
Tidligere anbefalte man høyere doser kortikosteroider ved hjerte- engasjement enn ved lungesarkoidose, men nå er den anbefalte prednisolondosen 30–40 mg med etterfølgende nedtrapping til 5–10 (15) mg pr dag og en total behandlingstid på 9–12 måneder. Enkelte anbefaler at behandlingen skal pågå opptil 3 år eller mer, da for tidlig seponering kan lede til dårligere LVEF på sikt. Flere års oppfølging etter avsluttet behandling er å anbefale (forslag på behandlingsskjema finnes i handlingsprogrammets behandlingsavsnitt).
Alternative eller supplerende behandlinger ved manglende effekt eller intolerable bivirkninger, er i første rekke metotrexat gitt én gang pr uke eller azatioprin gitt daglig (se behandlingsavsnitt i handlingsprogrammet).
Metotrexat i kombinasjon med prednisolon ga signifikant bedre effekt ved 3, men ikke ved 5 års oppfølgning. Begge behandlinger krever regelmessig kontroll av blodbilde samt lever- og nyrefunksjon (se kapittel Behandling).
Også såkalte biologiske legemidler, for eksempel infliksimab og adalimumab, har vært brukt i begrenset omfatning, uten at robuste vitenskapelige data støtter tiltaket. Ved bruk av denne type legemidler må man selvfølgelig utvise stor forsiktighet, med tanke på at det er rapportert en tendens til å framkalle hjertesvikt ved studier av ikke kardiell inflammasjon.
Rent generelt kan en mer aggressiv immundempende behandling være tiltalende initialt hos pasienter med utbredte inflammatoriske, men få fibrotiske forandringer, mens behandlingen kan være noe mer tilbakeholdende hos individer med små tegn til inflammasjon men med utbredt fibrose. Dette mot bakgrunn av den sannsynligvis lange behandlingstiden og risikoen for bivirkninger.
Monitoreringen av behandlingen må skje på individuell basis, og derved med varierende intervall, med forslagsvis MR, ekkokardiografi, biomarkører, og i enkelte tilfeller med PET/CT.
Rytmeregulering
Dersom det foreligger indikasjon for pacemaker pga rytmeforstyrrelser, anbefales oftest ICD, etter som pasientene løper en betydelig risiko for VT- attakker. Se nedenfor modifisert tabell fra Birnie DH et al Heart Rythm 2014; 11:1305-1323.
Håndtering av arytmier assosiert med hjertesarkoidose
Effekten av ablasjon er oftes begrenset,sannsynligvis pågrunnav forekomst av multiple arr somkan generere reentry- arytmier. Kateterablasjon kan kombineres med medikamentelle antiarytmisk behandling. Risikoen for residiverende VT er betydelig.
ICD-implantasjon
Anbefales (Birnie et al. Heart Rhythm 2014) ved spontan persisterende ventrikulær arytmi og tidligere hjertestans, dvs sedvanlig sekundærprofylaktisk indikasjon.
En sterk anbefaling om å implantere ICD primærprofylaktisk foreligger også hvis LVEF <35 % tross optimal medisinsk behandling inklusive hjertesviktbehandling og eventuell immunsupressiv behandling. Også ved LVEF mellom 35 % og 49 % og/ eller hvis høyre ventrikkels ejeksjonsfraksjon er under 40 %, kan ICD være aktuell. ICD kan også overveies dersom det foreligger indikasjon for pacemaker og pasienten har hatt uforklart besvimelse eller nærsynkope. ICD- implantasjon er også aktuell dersom en langvarig ventrikulær arytmi kan induseres.
Diagnose og screening Pasienter med diagnostisert ikke kardiell sarkoidose skal utspørres om forekomst av synkope/presynkope og signifikante palpitasjoner Ved konstatert sarkoidose i andre organer
Håndtering av ledningshinder
Håndtering av ventrikulære arytmier
|
Transplantasjon
Ved behandlingsrefraktære situasjoner kan transplantasjon være et alternativ. En studie viste at sjansen for at en pasient som bodde i Finland, og som ble diagnostisert med hjertesarkoidose, ikke trengte å transplanteres i en oppfølgingsperiode på 10 år, var 83 %. Dersom det ble gitt immunsuppresjon og pacemaker ble implantert, økte sjansen til 91 %. Fra andre etniske grupper er det rapportert dårligere prognose. Negative prognostiske faktorer er dilatert venstre ventrikkel og lav LVEF. Før en eventuell transplantasjon må det gjøres en grundig vurdering når det gjelder graden av samtidig lunge- engasjement. Det er en viss risiko for at sarkoidoseforandringer med tiden kan dannes i transplantatet.
Prognose
Den vanlige oppfatningen er at sykdomsprognosen ved sarkoidose er noe dårligere dersom det også kan påvises kardielle forandringer. Graden av dysfunksjon av venstre ventrikkel (vurdert på bakgrunn av LVEF) er hittil blitt ansett som den beste markøren for overlevelse hos pasienter med påvist hjerte- engasjement. Imidlertid har MR med vurdering av graden av «late gadolinium enhancement» (LGE) i venstre ventrikkel på senere tid framstått som en enda bedre prediktor for sykdomsforløpet. En metaanalyse viste at dersom LGE MR- forandringer kan påvises, innebærer det i seg selv en risiko for ventrikulære arytmier og kardiovaskulær død. Høyt opptak av LGE indikerer dårligere prognose. Også PET- opptak nevnes som betydningsfullt for prognosen, men LGE-MR synes, i alle fall i følge én studie, å være en sikrere metode.
Referanser
- Bernstein M, Konzelman FW, Sidlick DM. Boeck´s sarcoid: report of a case with viseceral involvement. Arch Intern Med 1929; 44: 721-734.
- Mehta D Lubitz SA, Frankel Z, Wisnivesky JP, Einstein AJ, Goldman M, Machac J, Teirstein A. Cardiac involvement in patients with sarcoidosis: diagnostic and prognostic value of outpatient testing. Chest 2008: 133(6): 1426-1435.
- Nunes H, Freynet O, Naggara N, Soussan M, Weinman P, Diebold B, Brillet PY, Valeyre D. Cardiac Sarcoidosis. Semin Respir Crit Care Med 2010: 31(4): 428-441.
- Handa T, Nagai S, Ueda S, Chin K, Ito Y, Watanabe K, et al. Significance of plasma NT-proBNP levels as a biomarker in the assessment of cardiac involvement and pulmonary hypertension in patients with sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis. 2010; 27(1): 27-35.
- Mantini N, Williams Jr B, Stewart J, Rubinsztain L, Kacharava A. Cardiac Sarcoid: A clinician's review on how to approach the patient with cardiac sarcoid. Clin Cardiol 2012: 35(7): 410-415.
- Sadek MM, Yung D, Birnie DH, Beanlands RS, Nery PB. Corticosteroid therapy for sarcoidosis: a systematic review. Can J Cardiol 2013; 29: 1034-1041.
- Birnie DH, Sauer WH, Bogun F, Cooper JM, Culver DA, Duvernoy CS, Judson MA, Kron J, Mehta D, Cosedis Nielsen J, Patel AR, Ohe T, Raatikainen P, Soejima K. HRS expert consensus statement on the diagnosis and management of arrhythmias associated with cardiac sarcoidosis. Heart Rhythm 2014; 11: 1305-1323.
- Hulten E, Aslam S, Osborne M, Abbasi S, Sommer Bittencourt M, Blankstein R. Cardiac sarcoidosis – state of the art review. Cardiovasc Diagn Ther 2015 dx.doi.org/10.3978/j.issn.223-3652.2015.12.13
- Vorselaars AD, van Moorsel CH, Zanen P, Ruven HJ, Claessen AM, van Velzen-Blad H, Grutters JC. ACE and sIL-2R correlate with lung function improvement in sarcoidosis during methotrexate therapy. Respir Med 2015; 109: 279-285.
- Kandolin R, Lehtonen J, Airaksinen J, Vihinen T, Miettinen H, Ylitalo K, Kaikkonen K, Tuohinen S, Haataja P, Kerola T, Kokkonen J, Pelkonen M, Pietilä-Effati P, Utrianen S, Kupari M. Cardiac sarcoidosis. Epidemiology, characteristics, and outcome over 25 years in a nationwide study. Circulation 2015; 131: 524-532.
- Kandolin R, Lehtonen J, Airaksinen J, Vihinen T, Miettinen H, Kaikkonen K, Haataja P, Kerola T, Kupari M. Usefulness of cardiac troponins as markers of early treatment response in cardiac sarcoidosis. Am J Cardiol 2015; 116: 960-964.
- Mehta D, Willner JM, Akhrass PR. Atrial fibrillation in sarcoidosis. JAFIB 2015; 8: 110-113.
- Al-Kofahi K, Korsten P, Ascoli C, Virupannavar S, Mirsaeidi M, Chang I, Qagish N, Saketkoo LA, Baughmann RP, Sweiss NJ. Management of extrapulmonary sarcoidosis: challenges and solutions. Ther Clin Risk Manag 2016; 12: 1623-1634.
- Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, Coats AJ, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2016; 37(27): 2129-2200.
- Martusewicz-Boros MM, Boros PW, Wiatr E, Zych J, Piotrowska- Kownacka D, Roszkowski-Śliż K. Prevalence of cardiac sarcoidosis in white population: a case-control study: Proposal for a novel risk index based on commonly available tests. Medicine (Baltimore) 2016; 95(32): e4518.
- Birnie DH, Kandolin R, Nery PB, Kupari M. Cardiac manifestations of sarcoidosis: diagnosis and management. Eur Heart J 2016 doi:10.1093/eurheartj/ehw328
- Birnie DH, Sauer WH, Judson MA. Consensus statement on the diagnosis and management of arrhytmias associated with cardiac sarcoidosis. Heart 2016; 102: 411-414.
- Sano M, Satoh H, Suwa K, Saotome M, Urushida T, Katoh H, Hayashi H, Sitoh T. Intra-cardiac distribution of late gadolinium enhancement in cardiac sarcoidosis and dilated cardiomyopathy. Worl J Cardol 2016; 8(9): 496-503.
- Young L, Sperry BW, Hachamovitch R. Update on treatment in cardiac sarcoidosis. Curr Treat Options Cardio Med 2017; 19:47. Doi:10.1007/s11936-017-0539-1
- Bravo PE, Raghu G, Rosenthal DG, Elman S, Petek BJ, Soine LA, Maki JH, Branch KR, Masri SC, Patton KK, Caldwell JH, Krieger EV. Risk assessment of patients with clinical manifestations of cardiac sarcoidosis with positron emission tomography and magnetic resonance imaging. Int J Cardiol 2017 dx.doi.org/10.1016/j.ijcard.2017.03.033
- Puntmann VO, Isted A, Hinojar R, Foote L, Carr-White G, Nagel E. T1 and T2 mapping in recognition of early cardiac involvement in systemic sarcoidosis. Radiology 2017 doi:10.1148/radiol.2017162732










