Akuttveileder i pediatri
8. Kardiologi
8.9 Kirurgiske shunter
Sist faglig oppdatert: 01.01.2021
- For å sikre og regulere blodtilførselen til lungene er det i en del tilfelle nødvendig å anlegge kirurgisk shunt.
- Dette kan være som palliasjon frem til reparasjon, som trinn i behandlingen av univentrikulære feil, eller som midlertidig løsning frem til avgjørelse om bi- eller univentrikulær reparasjon er mulig.
- Kirurgisk shunt kan være enten arteriell eller venøs.
- Kateterbasert stenting av PDA er et alternativ hos nyfødte.
Arterielle shunter for å sikre og regulere blodtilførselen til lungene
De vanligst brukte arterielle shunter er:
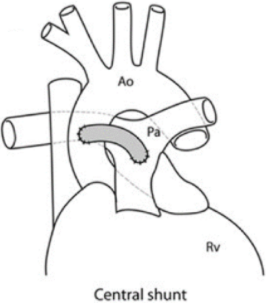
Sentral shunt: Et kort Goretexrør (3,5–4 mm diameter) lukkes med en klips i den ene enden der det stanses ut et hull i siden av røret som sys mot et tilsvarende utstanset hull i aorta ascendens. Den andre enden sys mot lungearteriens hovedstamme eller en sidegren. Dette er i dag (2021) den vanligste shunten, utenom ved Norwood operasjon stadium 1.
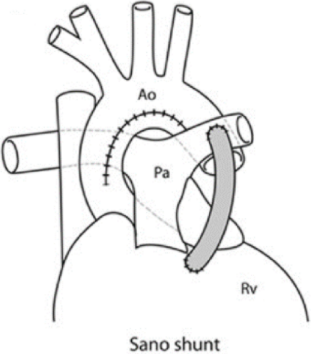
Sano shunt: 6 mm Goretexinterponat fra et hull i veggen på systemisk ventrikkel og andre enden sydd rett på pulmonalarterien. Denne brukes hovedsakelig ved Norwood operasjon stadium 1 for hypoplastisk venstre hjertesyndrom.
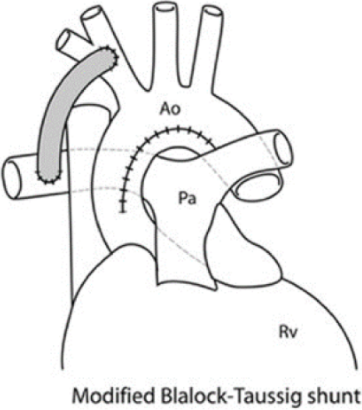
GOBT (Great Ormond Street modification of the Blalock Taussig) shunt: Goretex-interponat mellom a. subclavia (som ikke deles) og samme sides lungearteriesidegren. Denne brukes lite brukt i Norge i dag.
Andre arterielle shunter (mest aktuelt for GUCH): Waterston (aorta ascendens. side-til-side til høyre pulmonalgren), Potts (aorta descendens. side-til-side til venstre pulmonalgren), klassisk Blalock-Taussig (= BT-shunt, a. subclavia kuttes og kobles til lungearteriesidegrenen på samme side). Disse brukes i praksis lite med unntak av Potts shunt som prøves ut som alternativ til atrieseptostomi ved pulmonal hypertensjon, og ved PA/VSD/MAPCAS med dobbelt blodforsyning av lungene.
- Ved hjertefeil der det er en komplett blanding av ”rødt” og ”blått” blod, skal SpO2 ideelt ligge på 75–80 %, som tegn på balanse mellom pulmonal og systemisk sirkulasjon. Høyere SpO2 betyr oftest pulmonal hyperflow og bør unngås. (Dette gjelder ikke shunter ved tilstander der det ikke skjer full blanding, f.eks. Fallots tetrade eller DORV med streaming).
- De arterielle shunter legges med relativt liten dimensjon for å unngå pulmonal hyperflow. Dette medfører en viss risiko for trombosering (rapportert på mellom 7 og 49 %) hvilket kan være livstruende hvis shunten er pasientens eneste vei for blod til lungene. Disse pasientene skal rutinemessig behandles med acetylsalicylsyre (ASA), 3–5 mg/kg/d.
- Når pasienten vokser, vil shunten relativt sett gradvis bli mindre, med langsomt progredierende fall i SpO2.
- Ved akutt forverrelse og mistanke om trombose av livsnødvendig shunt (fravær av shuntbilyd og lav metning) gis en behandlingsdose lavmolekylært heparin (50 E/kg) før øyeblikkelig transport til OUS-Rikshospitalet for videre diagnostikk og behandling.
- Pasienter med dobbelt blodforsyning til lungene (nativ forsyning pluss shunt) kan ha en periode med pulmonal hyperflow, volumbelastet venstre ventrikkel og behov for sviktbehandling etter shuntoperasjon. Shuntopererte kan være ustabile postoperativt. Spesielt de minste nyfødte kan være vanskelige å regulere. Et lavt diastolisk blodtrykk uttrykker en shunt i største laget, tilsvarende en stor PDA. I intensivperioden – hvis forskjellen mellom diastolisk blodtrykk og CVP er under 20 mm Hg, må tiltak vurderes umiddelbart (volum, operativ reduksjon av shuntstørrelse).
- Mortalitet for pasienter med de vanligste typer arterielle shunter er rapportert opptil hele 30 %, hvilket viser at behandlingen kan ha høy risiko. Tall på mortalitet varierer betydelig med lesjon, type shunt og mellom publikasjoner. Vi har lav dødelighet i Norge. Anleggelse av arteriell shunt er også vist assosiert med takyarytmier i 20 % og bradyarytmier i 4 % av tilfeller. Risikofaktorer for shunttrombose er lav vekt, lav oksygenmetning, preoperativ hyperkoagulabel tilstand eller plateinfusjon, og smal shunt.
Venøse shunter for å sikre og regulere blodtilførselen til lungene
Dersom pasienten har en forbindelse fra ventrikkel til pulmonalarterien vil denne vanligvis kuttes ved anleggelse av venøs shunt – men ikke alltid. De vanligst brukte venøse shunter er:
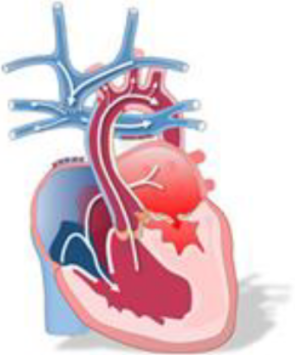
Bidireksjonal Glenn = bidireksjonal cavopulmonal forbindelse = BDCPC = BCPC = «halv-Fontan»: V. cava superior deles fra hø atrium og sys med enden til pulmonalarterien mens forbindelsen mellom høyre og venstre sidegren av pulmonalarterien beholdes. Oftest deles pulmonalarterien fra hjertet og sys over hvis ikke denne tenkes brukt senere.
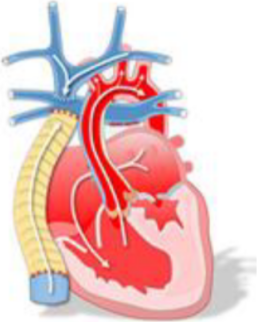
Total cavopulmonal forbindelse = TCPC = «Fontan»: Etter «halv-Fontan» operasjon vil neste operasjon kunne være en full «Fontan» der V. cava inferior deles fra hø atrium og sys til et 20 mm Goretex-rørgraft som føres forbi atriet og sys til lungearterien, ofte litt ut mot venstre.
"Halv-Fontan" og "Fontan" står i anførselstegn fordi dagens variant avviker fra den klassiske Fontan. Navnene brukes likevel i dagligtale.
- "Halv-Fontan"-pasientene ligger vanligvis på en SpO2 mellom 70 og 80 %. Gradvis stigende metningsverdier kan her være tegn på kollateraler som bør vurderes for coiling intervensjonelt før TCPC operasjon.
- TCPC-operasjoner kan gjøres med en fenestrasjon (dvs. liten åpning mellom «blå» og «rød» venøs side) hvilket medfører SpO2 i området 80–90 %. Fenestrasjonen kan gro igjen spontant eller lukkes med kateterteknikk på et senere tidspunkt, eller pasienten kan fortsatt leve videre med sin fenestrasjon. For tiden gjøres de fleste ufenestrert. ”Fontan”-pasienter uten fenestrasjon ligger oftest med SpO2 mellom 93–98 %. Ligger de lavere, må man mistenke veno-venøse kollateraler, eller lunge-AVM, spesielt ved økende desaturering under anstrengelse. Lunger som ikke mottar leverveneblod kan utvikle AVM (manglende såkalt faktor X).
Andre venøse shunter (mest GUCH-relevant):
- Klassisk Glenn shunt: Høyre pulmonalarteriesidegren deles av fra venstre, vena cava superior kobles til høyre sidegren.
- Laks (variant av TCPC): Høyre pulmonalarteriesidegren deles av fra venstre, vena cava superior kobles til venstre sidegren, vena cava inferior til høyre sidegren.
Viktig om venøse shunter:
- De venøse kirurgiske shunter innebærer ofte at blodstrømmen gjennom lungene er ikke-pulserende, hvilket medfører en risiko for trombose.
- Det er internasjonalt ingen konsensus om profylakse, men en god studie viser at ASA er like bra som warfarin. Ved OUS-Rikshospitalet er politikken livslang ASA-behandling, 3–5 mg/kg/dag.
- Pasienter med fenestrasjon får warfarin (INR 2–3) så lenge den er åpen, deretter ASA etter lukking. Enkelte pasienter uten fenestrasjon, men med spesiell indikasjon (trombosehistorie eller økt risiko) antikoaguleres med warfarin (INR 2–3) i kortere eller lengre tid etter TCPC operasjon.
- Det er det systemvenøse trykket, et visst sug fra pulmonalvenøst atrium samt respirasjonen som driver lungesirkulasjonen hos pasienter med Fontan sirkulasjon. De vil derfor vanligvis ha en lett stuvet og forstørret lever, uten at dette er tegn på hjertesvikt og dette skal normalt ikke medføre intensivering av diuretikabehandling.
- TCPC-pasientene er sårbare for hypovolemi og må unngå dehydrering, eksempelvis ved gastroenteritt o.l. (spesielt viktig ved opphold i varme strøk). Ved mistanke om hypovolemi som årsak til rask klinisk forverring gis f.eks. isotont saltvann eller Ringer 10 ml/kg over 1 time, raskere ved behov. Kan gjentas. Videre justering etter klinisk effekt.
Se også kapittel om akutte komplikasjoner ved univentrikulære tilstander.
Referanser
- Monagle P, et al. A multicenter, randomized trial comparing heparin/warfarin and acetylsalicylic acid as primary thromboprophylaxis for 2 years after the Fontan procedure in children. J Am Coll Cardiol. 2011; 58: 645-51.
- Thom KE, et al. Anticoagulation in children undergoing cardiac surgery. Semin Thromb Hemost. 2011;37:826-33
- White MH, et al. Incidence and Timing of Thrombosis After the Norwood Procedure in the Single-Ventricle Reconstruction Trial. J Am Heart Assoc. 2020; 9: e015882.
- Manlhiot C. Thrombotic complications and thromboprophylaxis across all three stages of single ventricle heart palliation. J Pediatr. 2012; 161: 513-9.
- Oster ME, et al. Development and impact of arrhythmias after the Norwood procedure: A report from the Pediatric Heart Network. J Thorac Cardiovasc Surg. 2017; 153: 638-45.
- Mahle WT, et al. Pediatric Heart Network Investigators. Heart failure after the Norwood procedure: An analysis of the Single Ventricle Reconstruction Trial. J Heart Lung Transplant 2018; 37: 879-85
- Vitanova K, et al. Risk Factors for Failure of Systemic-to-pulmonary artery shunts in biventricular circulation. Pediatr Cardiol 2018; 39: 1323-9
- Do N, et al. Shunt Failure-Risk Factors and Outcomes: An Analysis of The Society of Thoracic Surgeons Congenital Heart Surgery Database. Ann Thorac Surg 2018; 105: 857-64.
- Diab SG, et al. Fontan-sirkulasjon ved univentrikulære hjertefeil. Tidsskr Nor Laegeforen 2019;139(5)
Publisert 2006: Petter S. Hagemo, Egil Seem og Øyvind Skraastad
Revidert 2013: Henrik Brun og Egil Seem










