Generell veileder i pediatri
9.2.5 Hemoglobinsykdommer
9.2.5.2 Handlingsprogram for barn med sigdcellesykdom
Kapitteloversikt
- 9.2.1 Jernmangelanemi
- 9.2.2 Megaloblastanemeier
- 9.2.3 Hemolytiske anemier
- 9.2.4 Svikt i produksjon av røde blodlegemer
- 9.2.5 Hemoglobinsykdommer
- 9.2.5.1 Handlingsprogram for barn med thalassemi
- 9.2.5.2 Handlingsprogram for barn med sigdcellesykdom
Bakgrunn
Hemoglobinmolekylet er en tetramer som består av 4 globinkjeder, der sammensetningen av kjedene varierer i løpet av utviklingen fra tidlig fostertilværelse til det endelige voksne (”adulte”) hemoglobinet. I fosterlivet er hovedhemoglobinet HbF (føtalt hemoglobin) som består av to α- og to γ-globinkjeder (α2γ2), ved fødselen ca. 80 %. Etter fødselen skjer det en gradvis overgang til adult hemoglobin, HbA, som består av to α- og to β-kjeder (α2β2).
Sigdcelleanemi er en hemoglobinsykdom som skyldes en punktmutasjon (GAG → GTG, adenin → thymidin) i kodon 6 i genet for β-kjeder. Denne mutasjonen forårsaker at glutaminsyre substitueres med valin i 6-posisjon i β-globinkjeden. Mutasjonen forårsaker dannelsen av en forandret β-globinkjede, βS i stedet for den normale β-kjeden, og det dannes sigdcellehemoglobin, HbS (α2βS2). I homozygot tilstand (HbSS) erstattes alt HbA av HbS, mens hos heterozygotene (HbAS) kan man påvise begge hemoglobinformer, HbA og HbS, HbS i størrelsesorden 35–45 % (lavere ved samtidig α-thalassemi). Heterozygotene har en markert overlevelsesfordel når det gjelder malaria, og dette forklarer den store utbredelsen av HbS-genet i malariaområder. Epidemiologiske data viser at sigdcelleheterozygoter får malaria både sjeldnere og mindre alvorlig enn hematologisk normale, slik at dødeligheten blant HbShomozygoter mer enn oppveies av heterozygotenes overlevelsesfordel vis à vis normale i malariastrøk. HbS-genet har derved fått stor utbredelse, og HbS utgjør i disse områdene av verden en balansert polymorfisme med genfrekvenser > 20 % i enkelte områder av Ekvatorial-Afrika.
HbS kan også nedarves i kombinasjon med andre hemoglobinvarianter, hyppigst HbC, eller med thalassemimutasjoner. Kombinasjonene HbSC, HbSβ0-thalassemi eller HbSβ+-thalassemi gir sigdcellesykdom av varierende alvorlighetsgrad (i engelskspråklig litteratur brukes betegnelsen sigdcelleanemi [”sickle cell anaemia” – SCA] om HbSS og oftest også HbSβ0- thalassemi, mens betegnelsen sigdcellesykdom [”sickle cell disease” – SCD] er uspesifikk og omfatter også andre dobbelt heterozygote [HbSβ+, HbSC og andre varianter]). Sigdcelleanemi sammen med α-thalassemi (forekommer hos ca. 1/3 av pasientene med homozygot HbS [Kato mfl. 2007]) gir mindre grad av anemi, mindre risiko for cerebralt infarkt, men uendret eller økt tendens til vasookklusjon med smerter og skjelettsykdom sammenlignet med sigdcelleanemi alene.
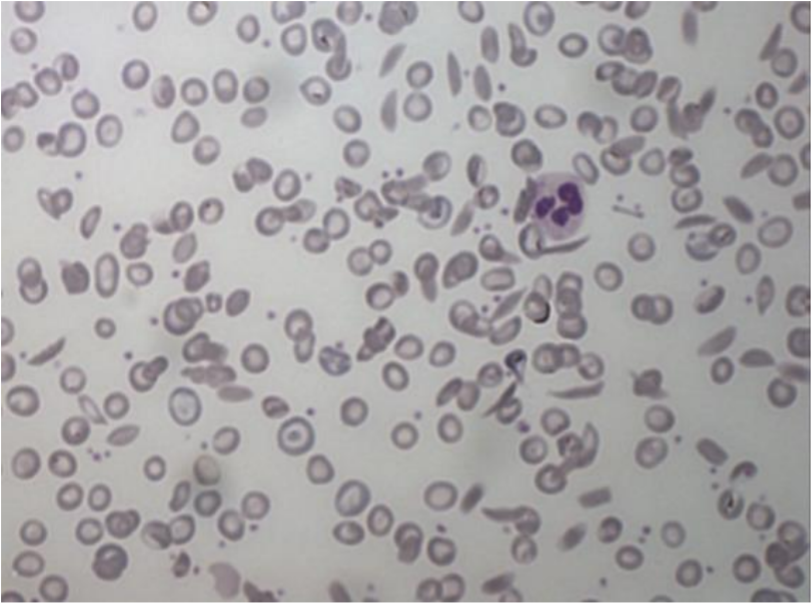
Sigdcellehemoglobin har den unike egenskap at det polymeriserer i deoksygenert tilstand. Tendensen til polymerisering øker ved acidose, langsom blod-flow og høy temperatur. Polymeriseringen gir økt intracellulær viskositet og forårsaker en formforandring av erythrocyttene som inntar en karakteristisk langstrakt, sigd-lignende form, en prosess som i engelskspråklig litteratur betegnes ”sickling”. Polymeriseringen og dermed formforandringen av erythrocyttene er til å begynne med reversibel ved reoksygenering, men blir etter hvert irreversibel. I blodutstryket kan man se de irreversibelt forandrede cellene som typiske sigdceller (figur). Gjentatte episoder med polymerisering/depolymerisering og tilhørende formforandring fører til membranskade, dannelse av frie radikaler og unormal kation-homeostase som resulterer i K+-tap fra cellene og intracellulær dehydrering. De deformerte røde blodlegemene fjernes av det retikuloendoteliale system, først og fremst milten. Sigdceller har økt adhesivitet til hverandre og til endotelceller, noe som bidrar til vasookklusjon og sekundær endotelskade. Skadet endotel tiltrekker seg nøytrofile granulocytter, og det oppstår en inflammatorisk prosess med redusert karlumen.
Kombinasjonen av endotelskade, inflammasjon, redusert karlumen og sigdceller kan gi vasookklusjon og vevsskade, dels i form av akutte mer eller mindre dramatiske episoder, dels kronisk med utvikling av organskade. Den inflammatoriske prosessen er en vesentlig komponent i de vasookklusive smertefulle krisene. Trombocyttene deltar også i den vasookklusive prosessen.
Pasienter med sigcelleanemi har ofte økt mengde HbF, men svært varierende (0.1–30 %). HbF inneholder ikke β-kjeder og deltar ikke i sickling-prosessen. Pasienter med en høy fraksjon HbF har derfor mindre tendens til sickling og vasookklusjon.
Diagnostikk
Det er av stor betydning å stille diagnosen så tidlig som mulig, og i mange land, også europeiske, er det derfor innført screening av nyfødte med henblikk på sigdcelleanemi (Davies SC mfl. 2000). Siden HbF ikke inneholder β-kjeder, er barna symptomfrie ved fødselen, og det er viktig å ha en høy grad av mistenksomhet overfor diagnosen hos alle barn av passende etnisk herkomst.
Utredning:
|
Det påvises en hemolytisk anemi som vanligvis er normocytær ved HbSS, mens MCV er lav ved HbSβ-thalassemi. Graden av anemi varierer sterkt. I første leveår kan Hb være normal eller tilnærmet normal, senere oftest i området 6–10 g/dL. Retikulocyttene er kraftig forhøyet som kompensasjon for hemolysen (erythrocyttenes levetid ved HbSS er bare 10–15 dager, hos normale 120 dager), ukonjugert bilirubin og LD er forhøyet, mens haptoglobin er lav. Hemoglobinopatiutredning viser at hovedhemoglobinet er HbS (som regel > 85 %), mens HbF er forhøyet i varierende grad. HbA2 (α22) er normal ved HbSS, forhøyet > 3.5 % ved HbSβ-thalassemi. Ved HbSC påvises ca. 50 % HbS og resten HbC/HbF. Tilstedeværende hemoglobinvarianter og deres nedbrytningsprodukter (HbS, HbC, HbE etc.) vil i varierende grad påvirke muligheten til å kvantitere HbA2, men ved påvisning av mikrocytose sammen med sekvensering av β-globingenet kan man likevel diagnostisere en samtidig β-thalassemi.
Klinikk
Sigdcelleanemi karakteriseres av kronisk hemolytisk anemi av varierende alvorlighetsgrad, tendens til vasookklusjon forårsaket av intravaskulær sickling og endotelskade, og økt infeksjonstendens forårsaket av nedsatt miltfunksjon. Milten er spesielt utsatt for sickling og infarsering på grunn av langsom blodflow, og de fleste pasientene med HbSS undergår en såkalt ”autosplenektomi” – fibrose på grunn av gjentatte miltinfarkter, i løpet av tidlig småbarnalder (senere ved HbSC og HbSβ-thalassemi). Det er karakteristisk at sigdcelleanemi viser stor klinisk variasjon, både mellom pasienter og fra tid til annen hos en enkelt pasient, fra nærmest symptomfrihet til et alvorlig sykdomsbilde med hyppige smertefulle kriser, livstruende infeksjoner og/eller chest syndrome og sterkt redusert livskvalitet. Det er nesten umulig å forutsi klinisk alvorlighetsgrad hos den enkelte pasient på diagnosetidspunktet (Steinberg 2005, Quinn mfl. 2007).
Sigdcellehemoglobin har nedsatt oksygenaffinintet, noe som gjør at vevsoksygeneringen kan være god selv ved temmelig lave hemoglobinverdier. Pasienter med sigdcelleanemi tolererer derfor godt en lav steady state-hemoglobinverdi. Siden HbS gir økt blodviskositet, er en lav hemoglobinverdi gunstig av reologiske hensyn, og en rekke av de kliniske komplikasjonene ved sigdcelleanemi er derfor hyppigere hos pasienter med høy steady state-Hb.
Det er vanlig å bruke betegnelsen sigdcellekriser om akutte sykdomsmanifestasjoner forårsaket av grunnsykdommen hos pasienter med sigcelleanemi. Det er tre typer kriser: vasookklusive kriser, sekvestreringskriser og aplastiske kriser. I tillegg kommer økt infeksjonstendens pga. nedsatt miltfunksjon fra tidlig barnealder, manifestasjoner av kronisk anemi og på lengre sikt kronisk organskade.
Sigdcellekriser
Vasookklusive kriser
Vasookklusive kriser er akutte, oftest smertefulle, episoder som skyldes intravaskulær sickling med karobstruksjon og vevsinfarsering. Dette er den hyppigste kliniske manifestasjonen av sigdcelleanemi. Akutt sickling kan utløses av infeksjoner, dehydrering, avkjøling eller psykiske påkjenninger, men er oftest uten kjent utløsende årsak. Prosessen kan i prinsippet forekomme hvor som helst i kroppen, men er vanligst i skjelett, lunger, lever, milt, hjerne og penis (spesielt hos større barn og voksne).
Dactylitt – ”hand-foot syndrome”
Dette er ofte den første kliniske manifestasjonen av sigdcelleanemi og arter seg ved smertefull hevelse i hender og føtter med affeksjon av en eller flere ekstremiteter. Patogenesen er vasookklusjon i benmargen i en eller flere av de små knoklene i hender og føtter. Sykdomsbildet er svært karakteristisk og bør reise mistanken om sigdcelleanemi om diagnosen ikke er stilt ved fødselen. Tilstanden opptrer fra tidlig i første leveår, er ofte residiverende, men er sjelden etter 5-årsalder fordi benmargsaktiviteten i hånd- og fingerknokler da oftest har forsvunnet. Tilstanden går som regel helt tilbake, men en sjelden gang kan den affiserte knokkelen bli forkortet eller deformert, spesielt hvis det blir sekundærinfeksjon.
Smertefulle ˮkriserˮ
Den mest karakteristiske kliniske manifestasjonen av sigdcelleanemi er de smertefulle episodene. Det er tatt til orde for at det er uheldig å bruke betegnelsen ˮkriserˮ, siden behandlingen bør settes inn lenge før smertesituasjonen er blitt kritisk (Expert Panel Report 2014), og i engelskspråklig litteratur er man i ferd med å erstatte betegnelsen «vaso-occlusive crisis» med «vaso-occlusive episode». Betegnelsen «krise» er likevel såpass innarbeidet at vi foreløpig fortsatt velger å bruke den.
Smerter kan opptre prinsipielt hvor som helst i kroppen, oftest i ryggen, nær leddene i de lange rørknoklene, sternum, ribbein eller bekkenet. Smertene er ofte multifokale. De smertefulle krisene tilsvarer dactylitt hos de minste barna. Smertene skyldes vasookklusjon av små benmargskar med ischemi og avaskulær nekrose av benmargen til følge. Prosessen gir en inflammatorisk respons, ledsages som regel av feber og CRP-stigning, og er ofte umulig å skille klinisk fra osteomyelitt. Det er stor variasjon i hyppigheten og alvorlighetsgraden av smertefulle kriser, fra tilnærmet symptomfrihet til stadige smertefulle kriser som krever sykehusinnleggelse og behandling med parenterale opioider. Definisjonsmessig snakker man om en alvorlig smertefull krise hvis den krever behandling på sykehus med parenterale opioider av minst 4 timers varighet, og vi snakker om alvorlig sigdcellesykdom ved 3 eller flere slike episoder per år. Pasienter med relativt høy Hb og lav fraksjon HbF er oftest mer plaget med smerter enn ved lav Hb og høy fraksjon HbF. Ofte ser man økt tendens til smerter hos gutter når de går inn i puberteten, og dette tilskrives den assosierte stigningen av Hb.
De fleste smertefulle episoder kan behandles hjemme, og det er av stor betydning å instruere pasienten og familien i betydningen av rikelig drikke, det å holde seg varm, optimal bruk av perorale analgetika, og ikke minst når det er behov for å komme til sykehus. Pasienter med sigdcelleanemi skal ha ”åpen dør” til sykehus. På sykehuset må man kartlegge eventuell underliggende infeksjon eller kirurgisk lidelse og starte optimal væske- og smertebehandling så snart som mulig.
Akutt ”chest syndrome” (ACS)
Vi har ikke noe godt norsk uttrykk for akutt chest syndrome (ACS). Betegnelsen omfatter akutt lungeskade med radiologiske infiltrater, oftest kombinert med brystsmerter, feber, hoste, tachypnoe og hypoksemi. En arbeidsdefinisjon definerer ACS som en tilstand med ”nytilkomne konsoliderende lungeinfiltrater som omfatter minst ett komplett lungesegment (ikke atelektase) med brystsmerter, feber > 38.5 ºC, tachypnoe, hvesing eller hoste hos en pasient med sigdcelleanemi” (Platt 2000). Akutt chest syndrome er en av hovedårsakene til morbiditet og mortalitet hos denne pasientgruppen. Betegnelsen innebærer at årsaken i hvert enkelt tilfelle som regel er ukjent, og det er et svært hensiktsmessig uttrykk fordi det understreker at det å vite den nøyaktige årsaken hos den enkelte pasient ikke er avgjørende for behandlingen, men derimot den løpende vurderingen av graden av lungeskade. Patogenetiske faktorer er vasookklusjon, hypoventilasjon (smertebetinget [postoperativt eller pga. smerter i thoraxveggen] eller sekundært til respirasjonshemmende medikamenter), infeksjoner, fettemboli og lungesekvestrering. ACS er hyppigere hos barn enn hos voksne, men voksne har generelt et mer alvorlig forløp som kan være assosiert med multiorgansvikt (Chaturvedi mfl. 2016).
Pasienter med SCD har generelt økt bronkial hyperreaktivitet, og astma er en hyppig komorbid tilstand. Samtidig astma øker risikoen for ACS. (Sylvester mfl. 2007, Newaskar mfl. 2011).
Klinisk bilde ved akutt chest syndrome
- Feber
- Brystsmerter
- Hoste, tachypnoe, hvesing, nesevingespill
- Nytilkomne lungeinfiltrater som omfatter minst ett helt lungesegment
- Hypoksemi
- Magesmerter
- Leukocytose
I en stor amerikansk multisenterstudie (Vichinsky mfl. 2000) som inkluderte 671 episoder med ACS hos 538 pasienter (barn og voksne), ble det påvist en definert årsak i 256 episoder (38 %), derav 157 med infeksjon og 53 med fettemboli. Det er viktig å merke seg at til tross for omfattende diagnostisk utredning som bl.a. inkluderte bronkoalveolar lavage (BAL) til mikrobiologiske undersøkelser og cytologisk undersøkelse med henblikk på lipidholdige makrofager, fant man likevel ikke noen sikker årsak i 62 % av tilfellene. I de tilfellene der infeksjon ble ansett å være årsaken, var Chlamydia og Mycoplasma de mikrobene som oftest ble påvist, deretter RS-virus, stafylokokker, pneumokokker og parvovirus B19.
Nesten halvparten av pasientene med ACS innkom under bildet av en ordinær smertefull krise uten lungesymptomer og uten røntgenologiske lungeforandringer, og det kliniske bildet av ACS utviklet seg i løpet av de første tre dagene etter at pasienten var innlagt i sykehus. Barn < 10 år hadde hyppigere feber, hvesing og hoste ved symptomdebut enn store barn og voksne som oftere hadde ekstremitetssmerter og dyspnoe. Tretten % av pasientene trengte respiratorbehandling, men bare 3 % av pasientene døde. Forløpet var mest alvorlig hos de voksne pasientene (> 20 år). Gjennomsnittlig varighet av sykehusoppholdet var 10.5 dager. Mange av pasientene hadde flere episoder med ACS i løpet av studien.
I 2020 opplever vi en pandemi med et nytt virus, SARS-CoV-2, som gir sykdommen covid19. Covid-19 forårsaker alvorlig lungesykdom hos mange pasienter, også tidligere friske mennesker. Pasienter med SCD som i utgangspunktet har økt risiko for alvorlig lungesykdom ved infeksjoner, oppfattes å ha betydelig økt risiko for et alvorlig forløp ved covid-19- infeksjon, men datagrunnlaget er foreløpig sparsomt.
Pasienter med relativt høy Hb, lav fraksjon HbF og høyt nivå av hvite blodlegemer i steady state er spesielt utsatt for å få ACS. Etter gjentatte episoder kan det utvikles sekundær lungefibrose.
Behandlingen av ACS bygger på de generelle behandlingsprinsippene ved sigdcellekriser og omfatter væskebehandling, smertebehandling, infeksjonsbehandling, oksygen, bronkolytisk behandling, transfusjoner og nøye monitorering. Siden mange tilfeller av ACS starter som ordinære smertefulle kriser, må alle pasienter innlagt for smertefulle kriser overvåkes tett til symptomene er klart på retur. Mer enn ved noen annen komplikasjon er kanskje den tette monitoreringen av klinisk bilde, oksygenering, lungerøntgen, hematologiske og biokjemiske parametre og infeksjonssituasjon, med tidlig intervensjon ved behov, helt avgjørende for utfallet (Crabtree mfl. 2011).
Pulsoksymetri ved sigdcelleanemi er unøyaktig på grunn av HbS’s lave oksygenaffinitet (forskyvning av oksyhemoglobinets dissosiasjonskurve mot høyre) og tendens til forhøyet karboksyhemoglobin og methemoglobin. Det er beskrevet både over- og underestimering av den reelle oksygenmetningen (Blaisdell mfl. 2000, Fitzgerald og Johnson 2001). Som kontinuerlig oppfølging anses pulsoksymetri likevel velegnet. Man bør tilstrebe en metning over 92 % (Johnson 2005). Ved transfusjon må man passe på ikke å overtransfundere slik at viskositeten øker, dvs. Hb skal ikke overstige 10 g/dL. Det er vist at transfusjoner kan bedre oksygeneringen, men det er ikke vist at utskiftningstransfusjon er bedre enn enkle påfyllingstransfusjoner (Vichinsky mfl. 2000, Miller 2011). Det anbefales likevel å utføre utskiftningstransfusjon som øyeblikkelig hjelp-prosedyre ved alvorlig ACS med truende respirasjonssvikt, dels for om mulig å stoppe/reversere sickling-prosessen, dels for å unngå problemer knyttet til for høy viskositet (Johnson 2005).
Overvåkning ved mistanke om chest syndrome
|
Behandling av akutt chest syndrome
- Smertebehandling
Målet med smertebehandlingen er smertefrihet uten respirasjonsdepresjon. Oftest må man bruke en kombinasjon av ikke-opioide analgetika (paracetamol, NSAIDs), opioider og adjuvantia.- Paracetamol. Alle pasientene bør få en basismedikasjon med paracetamol
- NSAIDs. Vi har oftest brukt diklofenac (1 mg/kg x 2–3 [godkjent for barn > 6 år]).
Et alternativ kan være ketorolac (Toradol®) som i litteraturen anbefales som et utmerket ikke-sederende smertestillende medikament nettopp ved ACS hos barn og ungdom (ikke anbefalt til voksne pga. økt risiko for toksisitet). Dose: 0,5 mg/kg i.v. (max. 30 mg), kan gjentas hver 6. time (0.5 mg/kg, max 15 mg) i inntil 3 (–5) dager, må ikke kombineres med andre NSAIDs (Heeney og Mahoney, UpToDate 2020) - Opioider. De fleste pasienter med ACS krever smertebehandling med opioider, enten peroralt eller parenteralt. Optimal smertelindring er helt avgjørende for å avverge smertebetinget hypoventilasjon, men pasientene er samtidig svært utsatt for og sårbare for medikamentell respirasjonshemning og må derfor overvåkes kontinuerlig. Ved behov for parenteral opioidtilførsel vil kontinuerlig infusjon i form av PCA (= ”patient controlled analgesia”) ofte være den beste løsningen (hos barn over ca. 7 år).
- Adjuvantia. Antiemetika og angstdempende medikamenter kan være nyttige som tillegg til de rene smertestillende medikamentene, dessuten antihistaminer (mot kløe).
- Væskebehandling
Dehydrering korrigeres med isoton væske, deretter anbefales vedlikeholdsbehov pluss eventuelt økt behov pga. feber. Lett hyponatremi (130–135 mmol/L) behøver ikke korrigeres, hypernatremi må unngås. Cave overvæsking!! – disse pasientene er utsatt for lungeødem som forverrer tilstanden. Det må føres nøyaktig væskeregnskap, gjøres løpende elektrolyttkontroll, og pasienten må veies daglig. Enkeltdoser med furosemid kan bli nødvendig ved tegn på overvæsking. - Infeksjonsbehandling
Alle pasienter med ACS må behandles med antibiotika. Det anbefales som regel et cefalosporin + et makrolid, evt. + antiviral behandling (oseltamivir [Tamiflu®]) i influensasesongen (Miller 2011). Selv om det i mange tilfeller ikke er påvist noe infeksiøst agens, er det ingen mulighet til å skille infeksjoner fra andre årsaker til ACS. - Bronkolytisk behandling
Siden astma hos pasienter med sigdcelleanemi er svært hyppig, er det rimelig å behandle med bronkolytica, og det er vist i flere studier at bronkolytisk behandling bedrer oksygeneringen, også hos pasienter som ikke har noen astmadiagnose på forhånd (Vichinsky mfl. 2000, Blake og Lima 2011). - Transfusjoner
Målet med transfusjon ved ACS er dels å bedre oksygeneringen, dels å stoppe eller helst reversere sickling-prosessen. Det er av stor betydning å unngå å transfundere til høyere Hb enn ca. 10 g/dL, da viskositetsøkning vil forverre situasjonen i lungene.- ACS ledsages ofte av Hb-fall som vil kunne indisere transfusjon. I så fall bør man gi en enkel påfyllingstransfusjon. Enkel transfusjon bør også i noen tilfeller gis i påvente av utskiftningstransfusjon, hvis det tar tid å organisere denne.
- Ved raskt progredierende symptomer eller truende respirasjonssvikt skal det utføres utskiftningstransfusjon så snart som mulig. Målet er å senke fraksjonen HbS til < 30 % uten å heve Hb mer enn til ca. 10 g/dL. Transfusjonen kan eventuelt gjennomføres i form av erythrocyttaferese hvis dette er tilgjengelig. Indikasjoner for utskiftningstransfusjon:
- Progredierende metningsfall
- Fall i PaO2 ved uendret FiO2 (økende A-a [alveolo-arteriell] O2-gradient)
- Økende lungeinfiltrater
- Økende tachycardi og respirasjonsarbeid
- Manglende bedring etter enkel påfyllingstransfusjon
- Tidligere gjennomgått alvorlig ACS
- Respirasjonsstøtte
Det er beskrevet forskjellige teknikker for respirasjonshjelp som skal avverge alveolært kollaps:- CPAP/Bi-PAP (Padman and Henry 2004, Miller 2011)
- ”Incentive spirometry” (Bellet mfl. 1995, Vichinsky mfl. 2000).
- Inhalert NO – det er ikke overbevisende dokumentert at inhalert NO bedrer prognosen ved ACS (Heeney og Mahoney, UpToDate 2015), men i en randomisert studie ved moderat ACS var det færre tilfeller av terapisvikt blant hypoksemiske pasienter i NO-gruppen enn i placebogruppen (Maitre mfl. 2015).
- Respiratorbehandling
- ECMO
- Steroider
Behandling med corticosteroider ved ACS er omdiskutert, men ved samtidig astma anbefales steroider som ved astmabehandling, dvs. prednisolon 1–2 mg/kg/døgn (eller metylprednisolon i ekvivalent dose) (Miller 2011). Ved bruk av steroider anbefales langsom nedtrapping for å unngå rebound effekt (Newaskar mfl. 2011, Heeney og Mahoney, UpToDate 2020). - Sekundærprofylakse
Pasienter som har gjennomgått ACS har stor risiko for gjentatte episoder, og det anbefales sekundærprofylakse med hydroksyurea til alle barn etter en gjennomgått episode av ACS (Miller 2011, Heeney og Mahoney, UpToDate 2020). Det er vist i en rekke studier at behandling med hydroksyurea reduserer frekvens og alvorlighetsgrad av ACS hos voksne og barn (Amrolia mfl. 2003, review). Regelmessige transfusjoner reduserer også forekomsten av ACS (Hankins mfl. 2005). Pasienter med astma må ha inhalasjonssteroider om de ikke har brukt det tidligere (Blake og Lima 2011). Pasienter med hyppige episoder med ACS kan ha nytte av regelmessige transfusjoner, eventuelt i form av utskiftningstransfusjoner. De kan også være aktuelle kandidater for stamcelletransplantasjon (Amrolia mfl. 2003).
Abdominal smertefull krise
Abdominalsmerter hos en pasient med sigdcelleanemi kan skyldes projisert smerte fra sickling i ryggvirvler eller ribbein, sickling/ischemi i mesenterialkar, galleveispatologi (gallestein, cholecystitt) eller hepatisk vasookklusiv krise. Ofte finner man generelt utspilt abdomen, diffus ømhet, svake eller fraværende tarmlyder, og utvidede tarmslynger på oversiktsbilder. Differensialdiagnosen overfor en akutt kirurgisk abdominallidelse er vanskelig, men det er vanligvis riktig å være avventende med kirurgi hvis det ikke er en overbevisende kirurgisk årsak til smertene.
Behandlingen er som ved smertefulle kriser andre steder: væske, smertebehandling, antibiotika (cefalosporin + metronidazol), transfusjoner på streng indikasjon, og nøye monitorering. Husk differensialdiagnosen basal pneumoni/akutt chest syndrome ved smerter i øvre del av abdomen, og risikoen for sekundært ACS ved smertebetinget hypoventilasjon.
Ved cholecystitt bør det gjøres cholecystektomi i rolig fase senere.
Priapisme
Ischemisk priapisme1 er en ufrivillig, smertefull, langvarig ereksjon med varighet over 4 timer2 uavhengig av seksuell stimulering (Broderick 2012, Expert Panel Report 2014). Priapismen kan være forutgått av ”stuttering priapism” som betegner gjentatte selvbegrensede ereksjoner, ofte med gradvis økende intensitet. Priapisme er hyppig; i en studie var insidensen 35 % av voksne menn med sigdcellesykdom (Adeyoju mfl. 2002). Median alder for første episode var 15 år, og 75 % hadde hatt sin første episode før fylte 20 år. Tilstanden er ofte residiverende og kan være assosiert med senere impotens. Pasientene finner ofte selv ut manøvrer som kan få ereksjonen til å gå tilbake: vannlatning, gymnastiske øvelser, ejakulasjon, varmt bad eller dusj, og smertestillende medikamenter. Kalde bad må ikke brukes, da dette vil utløse sickling i omkringliggende områder. Det er viktig å søke sykehushjelp i tide, for hvis ereksjonen ikke går tilbake i løpet av 4 timer, er det risiko for permanent skade av penis. Behandlingen på sykehus er i utgangspunktet som ved andre sigdcellekriser, væske og smertestillende (opioider). Transfusjoner er kontroversielt ved denne tilstanden. Anxiolytika er ikke vist å ha effekt på selve ereksjonen og må ikke forsinke annen behandling. Hvis varigheten nærmer seg 4 timer, må urolog kontaktes med henblikk på aspirasjon av blod fra corpus cavernosum, skylling med saltvann, og eventuelt injeksjon av en liten dose efedrin eller et annet α-adrenergt medikament (obs. risiko for blodtrykkstigning!).
Denne prosedyren kan bevare evnen til normal ereksjon senere.
For å forhindre senere anfall er det rapportert mulig effekt av behandling med α-adrenerge medikamenter (Olujohungbe mfl. 2011) eller sildenafil (Broderick 2012, Burnett mfl. 2014).
Studiene har få inkluderte pasienter og er utilstrekkelige til å gi noen kvalifisert anbefaling (Chinegwundoh mfl. 2017).
1 Non-ischemisk priapisme eller arteriell priapisme omtales ikke her.
2 Langvarig ereksjon opp til 4 timers varighet kalles prolongert ereksjon
Sekvestreringskriser
Ved sekvestreringskriser oppstår det en akutt opphopning av blod i et distenderbart organ, og hos sigdcellepasienter forekommer dette i milt eller lever. Miltsekvestrering gir oftest et mer alvorlig forløp enn leversekvestrering fordi miltkapselen er mer ettergivelig enn leverkapselen, slik at en større andel av blodvolumet hopes opp der.
Miltsekvestrering
Klinisk kjennetegnes miltsekvestrering ved en akutt økning av miltstørrelsen ledsaget av rask utvikling av anemi og hypovolemi. Som definisjon bruker man ofte at Hb faller > 2 g/dL fra pasientens steady state-verdi kombinert med splenomegali og en aktiv erythropoiese. Den akutte miltforstørrelsen ledsages av magesmerter, blekhet, tachycardi, tachypnoe og utvikling av hypovolemisk sjokk. Forløpet kan være fulminant, med død i løpet av noen få timer.
Tilstanden opptrer hyppigst i alderen 4 måneder – 5 år og er en viktig dødsårsak hos de yngste pasientene. Miltsekvestrering kan hos en del pasienter være første symptom på sykdommen.
Den opptrer ofte i sammenheng med en banal infeksjon, og feber er et vanlig ledsagersymptom (Brousse mfl. 2012). Det er mistanke om at behandling med hydroksyurea forlenger risikoperioden for miltsekvestrering, se senere (de Montalambert mfl. 2006).
Risikoen for miltsekvestrering og risikoen for invasive pneumokokkinfeksjoner er de to viktigste argumentene for screening av nyfødte med henblikk på sigdcelleanemi. Foreldrene må læres opp til å palpere milten, slik at de kan bringe barnet til sykehus med en gang en miltsekvestrering utvikler seg. Blodbildet viser karakteristisk anemi, retikulocytose, trombocytopeni og kjerneholdige erythrocyttforstadier i blodutstryket.
Behandling
Tilstanden kan gå tilbake av seg selv, men de fleste tilfeller krever aktiv behandling med volumtilførsel og som regel en enkel forsiktig transfusjon (til Hb ca. 8 g/dL [Expert Panel Report 2014], anslagsvis 5 ml/kg initialt). I løpet av noen dager vil hemoglobin stige mer enn det tilførte blodvolumet skulle tilsi, noe som illustrerer at det blodet som har vært samlet opp i milten, igjen blir tilgjengelig for sirkulasjonen. I denne fasen øker blodets viskositet, og risikoen for en sekundær vasookklusiv krise er økt. Barnet må derfor overvåkes nøye i dagene etter transfusjon med seriemålinger av Hb/hct og nevrologisk vurdering med henblikk på cerebralt infarkt (Glassberg 2011).
Sekundærprofylakse
Miltsekvestrering har stor tendens til å komme igjen (ca. 50 %), og siden hver episode er potensielt livstruende, er det et stort behov for sekundærprofylakse. Regelmessige transfusjoner har ikke dokumentert sikker effekt som sekundærprofylakse. Splenektomi eliminerer risikoen for gjentagelse, men siden barna som regel er svært små, vil mange vegre seg for å utføre splenektomi etter en enkelt episode på grunn av frykt for at infeksjonsrisikoen skal øke ytterligere. I en studie fra Jamaica (Wright mfl. 1999) av 130 splenektomerte sigdcellepasienter gjennom en periode på 22.5 år, ble det ikke sett økt antall dødsfall, sepsistilfeller eller bakteriemiepisoder hos de splenektomerte sammenlignet med en ikkesplenektomert kontrollgruppe, men derimot økt antall smertefulle kriser og ACS i den splenektomerte gruppen. De fleste anbefaler i dag splenektomi etter 2 tilfeller av miltsekvestrering, etter forskriftsmessig pneumokokk- og meningokokkvaksinering, med penicillinprofylakse og med grundig informasjon til familien (Kinney mfl. 1990, Brousse mfl. 2012).
Slag (cerebralt infarkt, ”stroke”)
De fleste hjerneslag hos barn med sigdcelleanemi er ischemiske (hos voksne oftere hemorrhagiske) og skyldes karsykdom med okklusjon i store kar, oftest den intrakranielle delen av a. carotis interna, a. cerebri media eller a. cerebri anterior. Hemiparese er hyppigste debutsymptom. Høyest insidens i barnealder er mellom 2 og 5 år, gradvis avtagende mot 10-årsalder. Ved naturlig forløp ser man en økende insidens igjen etter 20-årsalder. I USA er det beregnet en kumulativ insidens på 11 % ved 20-årsalder, 24 % ved 45-årsalder, litt lavere i andre befolkningsgrupper (Abboud and Atweh 2006). Etter et gjennomgått slag i barnealder anslås residivrisikoen til ca. 67 % med de fleste residivene de første 3 årene etter infarktet hos pasienter som ikke får sekundærprofylaktisk behandling (Hoppe 2004, Wong and Powars 2005). Karsykdom i mindre kar kan gi kognitive forstyrrelser og ”stumme” infarkter på MRundersøkelse.
Det er beskrevet en rekke kliniske og andre risikofaktorer for slag hos sigdcellepasienter. Til forskjell fra ved smertefulle kriser og akutt chest syndrome ser høy fraksjon HbF ikke ut til å beskytte mot slag. Kliniske risikofaktorer for slag er uttalt anemi, både kronisk og akutte episoder, høye hemolyseparametre (retikulocytter, LD), høyt antall leukocytter, gjennomgått TIA (transitorisk ischemisk attakk), nattlige hypoksiepisoder, og ikke minst gjennomgått ACS.
Det er godt dokumentert at barn med stor risiko for å utvikle cerebralt infarkt kan identifiseres ved hjelp av transkraniell Doppler-undersøkelse (TCD), som fremstiller flowhastigheten i distale a. carotis interna, a. cerebri anterior og a. cerebri media. Hastigheter < 170 cm/s defineres som normale, 170-199 cm/s som grenseverdi (”conditional”), mens hastighet ≥ 200 cm/s er patologisk forhøyet. Det er vist at regelmessige transfusjoner til pasienter i risikogruppen (TCD-verdier ≥ 200 cm/s) for å holde fraksjonen HbS < 30 %, ga en signifikant reduksjon i hyppigheten av cerebralt infarkt i den transfunderte gruppen med 92 % sammenlignet med kontrollgruppen (”STOP”-studien, Adams mfl. 1998), et funn som er verifisert i andre studier senere (Bernaudin mfl. 2011). Etter at ”STOP”-studien ble kjent, gikk frekvensen av førstegangs slag hos barn med sigdcelleanemi i California drastisk ned (Fullerton mfl. 2004). Det er senere vist at slagfrekvensen økte igjen hos pasienter fra STOPstudien som avsluttet transfusjonsbehandlingen (”STOP II”, Adams mfl. 2005), og i denne gruppen tilkom det også en økning av MR-påviste stille infarkter (Abboud mfl. 2011).
Diagnostikk
Definisjonen av slag, TIA og stumme infarkter er dels klinisk, dels billedmessig. Vanligvis defineres TIA som en episode av < 24 timers varighet hvis den ikke ledsages av infarktforandringer på MR. MR er den beste undersøkelsen for å påvise infarkt, mens CT kan brukes i akutte situasjoner for å fastslå eventuell blødning eller masseeffekt. Man bør helst unngå bruk av kontrast ved CT fordi røntgenkontrastmidler er hypertone og kan utløse eller forverre sickling. MR-undersøkelsen bør inkludere diffusjonsvekting og MR-angiografi.
Behandling ved akutt cerebralt infarkt
- Utskiftningstransfusjon. Pasienter som har gjennomgått slag, har blitt behandlet med enten en enkel transfusjon eller utskiftningstransfusjon i den akutte fasen, men utskiftningstransfusjon anbefales, og det bør utføres så snart som mulig (Expert Panel Report 2014). En retrospektiv studie sammenlignet residivfrekvensen hos pasienter som gjennomgikk initial utskiftningstransfusjon med pasienter som fikk en enkel transfusjon, før begge gruppene ble innrullert i et regelmessig transfusjonsprogram av minst 5 års varighet (Hulbert mfl. 2006). Det var signifikant færre residiv hos gruppen som fikk initial utskiftningstransfusjon, enn i gruppen behandlet med initial enkel transfusjon. For prosedyre ved utskiftningstransfusjon, se avsnittet om transfusjoner.
Primærprofylakse
- Transfusjoner. Det er klart vist (Adams mfl. 1998) at regelmessige transfusjoner som holder fraksjonen HbS < ca. 30 %, beskytter sigdcellepasienter mot cerebralt infarkt. Ved økt hastighet i a. cerebri media eller distale a. carotis interna ≥ 200 cm/s er risikoen for slag 10 % pr. år ubehandlet, men reduseres til 1 % ved regelmessige transfusjoner. Det er derfor anbefalt at alle barn med sigdcelleanemi skal undersøkes med TCD regelmessig fra 2-årsalder for å identifisere de pasientene som har økt risiko for slag, og tilby dem behandling med transfusjoner.
- Hydroksyurea. Transfusjoner er forbundet med komplikasjoner, først og fremst risiko for immunisering, blodbårne infeksjoner og jernopphopning. Immunisering er relativt hyppig og vil i noen tilfeller umuliggjøre gjennomføringen av et transfusjonsprogram. Det har vist seg at det i praksis kan være vanskelig å nå målet om < 30 % HbS hos transfunderte pasienter (Aygun mfl. 2011). En del pasienter viser seg også å være ute av stand til å følge opp et regelmessig transfusjonsprogram med jernchelerende behandling. Flere studier av hydroksyurea som primær- og sekundærprofylakse mot cerebralt infarkt har vist bedring til normalisering av økt hastighet i intrakranielle kar målt ved TCD (Zimmerman mfl. 2007, Lefèvre mfl. 2008), og også en delvis beskyttelse mot cerebralt infarkt/nevrologiske hendelser (Ware mfl. 2004, 2012).
I studien av Bernaudin (2011) nevnt ovenfor, ble en hel kohort med barn med sigdcelleanemi i Frankrike fulgt fra nyfødtperioden, med svært tett oppfølging som inkluderte hyppige TCD-undersøkelser med start allerede ved 12–18 måneders alder, supplert med MR-undersøkelser (MRI) fra 5-årsalder eller tidligere ved patologisk TCD.
Pasienter med unormal TCD som normaliserte seg under transfusjonsbehandling, og som hadde normale kar ved MR-angiografi (MRA), ble overført til behandling med hydroksyurea under nøye kontroll med TCD hver 3. måned, og det viste seg at 3 av 13 pasienter igjen utviklet patologisk TCD med vaskulopati, noe som medførte gjenopptakelse av transfusjonene, mens de 10 øvrige kunne fortsette på bare HU. HUdosen er ikke spesifisert i denne studien.
Det er senere publisert en studie der man sammenlignet regelmessige transfusjoner med transfusjoner etterfulgt av HU som primærprofylakse mot cerebrovaskulær sykdom hos pasienter med økt hastighet i intrakranielle kar målt ved TCD (TCD With Transfusions
Changing to Hydroksyurea – TWiTCH). Studien er en videreføring av SWiTCH-studien beskrevet nedenfor (Aygun mfl. 2011, Ware mfl. 2016). I TWiTCH-studien ble hydroksyureadosen trappet opp til høyeste tolererte dose (moderat benmargshemning) mens transfusjonene ble trappet gradvis ned samtidig over 4–9 måneder. Studien ble gjennomført under tett overvåkning i form av hyppige TCD- og MRI-/MRA-undersøkelser. Resultatene viser at det forutsatt meget langsom nedtrapping av transfusjonene ser ut til å kunne være trygt å gå over til primærprofylakse med HU, i hvert fall til en andel av pasientene (Ware mfl. 2016). - Et tredje alternativ er allogen hematopoietisk stamcelletransplantasjon som kan helbrede hemoglobinsykdommen.
Sekundærprofylakse
- Transfusjoner. Etter initial utskiftningstransfusjon skal pasienten tilbys et regelmessig transfusjonsprogram med mål å opprettholde HbS < 30 %. Dette kan oppnås enten ved enkle påfyllingstransfusjoner til Hb ca. 12 g/dL, eller ved gjentatte utskiftningstransfusjoner/erythrocyttafereser. Etter resultatene i STOP II-studien er anbefalingen et livslangt transfusjonsprogram (Adams mfl. 2005).
- Overgang til hydroksyurea (HU) – ? Enkelte tidligere studier har tydet på at det er trygt med sekundærprofylakse i form av HU-behandling så lenge overgangen fra transfusjoner til HU skjer over flere måneder med gradvis nedtrapping av transfusjonene (Ware 1999, 2004). En randomisert studie (Ware mfl. 2012) på pasienter etter gjennomgått cerebralt infarkt sammenlignet fortsatte transfusjoner/jernchelerende behandling med overgang til hydroksyurea kombinert med flebotomi for å undersøke både risikoen for sekundære cerebrale infarkter/andre nevrologiske hendelser og reduksjonen i leverens jerninnhold (Stroke With Transfusions Changing to Hydroksyurea – SWiTCH). Studien viste en overvekt av nytt cerebralt infarkt i gruppen behandlet med HU/flebotomi, mens hyppigheten av andre nevrologiske hendelser var likt fordelt i de to gruppene. HU er med dagens viten ikke akseptert som et fullgodt alternativ til transfusjoner som sekundærprofylakse, men pga. alle problemene knyttet til langvarig transfusjonsbehandling brukes det likevel i en viss utstrekning. Det er mulig at kombinasjonen transfusjoner/HU gir en tilleggsgevinst pga. HUs antiinflammatoriske effekt (Helton mfl. 2014). TWiTCH-studien beskrevet ovenfor inkluderte ikke barn som hadde gjennomgått et cerebralt infarkt, og sier derfor ikke noe om dette.
- Allogen stamcelletransplantasjon (SCT).
Infeksjoner
Infeksjoner er den viktigste dødsårsaken hos barn med sigdcelleanemi. Pasientene har redusert infeksjonsforsvar, dels forårsaket av redusert/opphevet miltfunksjon, dels av andre årsaker. Den økte infeksjonstendensen er til stede allerede tidlig i første leveår og er hovedårsaken til at det er så viktig å stille diagnosen tidlig. Den største risikoen de første leveårene er invasive pneumokokkinfeksjoner. Det er klart dokumentert at penicillinprofylakse frem til 5-årsalder reduserer både insidensen av og mortaliteten ved pneumokokksepsis (John mfl. 1984, Gaston mfl. 1986). Etter 5-årsalder er det ikke dokumentert at fortsatt penicillinprofylakse gir beskyttelse.
Det er en økende forekomst av penicillinresistente pneumokokkstammer, i noen tilfeller også kombinert med cefalosporinresistens. Derfor er det av stor betydning at penicillinprofylakse kombineres med pneumokokkvaksinering (Adamkiewicz mfl. 2003, Miller mfl. 2005). Det anbefales pneumokokk-konjugatvaksine (PCV/PKV) ved 2-månedersalder eller så snart diagnosen er stilt, antall doser aldersavhengig som anbefalt av fabrikanten. Deretter anbefales polysakkaridvaksine (PPSV23/PPV23) ved 2-årsalder med revaksinasjon ca. hvert 5. år resten av livet. Det er vist at konjugatvaksinen gir god antistoffrespons hos sigdcellepasienter fra 2- månedersalder, like god som hos barn uten sigdcelleanenmi (O’Brian mfl. 2000). Pga. økt forekomst av lokale bivirkninger av PPSV23-vaksinen hos barn og ungdom med SCD, advares det mot å gi denne vaksinen samtidig med andre vaksiner, og det er nå også anbefalt ikke å revaksinere oftere enn hvert 5. år (Han mfl. 2015).
I California er det beskrevet en markert nedgang av invasive pneumokokkinfeksjoner i befolkningen etter innføring av konjugert pneumokokkvaksine (Black mfl. 2004). Tilsvarende er dokumentert hos pasienter med SCD med en reduksjon av invasiv pneumokokksykdom på > 90 % hos barn < 5 år etter innføring av PCV7 (Halasa mfl. 2007). Det er også dokumentert redusert infeksjonsrelatert dødelighet på hele 70 % hos små barn (0–3 år) med sigdcelleanemi for hele USA etter innføring av PCV7-vaksinen, samtidig med en reduksjon av SCDdødelighet uten registrert infeksiøs årsak på 18 % (Yanni mfl. 2009).
Barn med sigdcelleanemi har også økt risiko for infeksjoner med Haemophilus influenzae gruppe B og for salmonellainfeksjoner, spesielt i skjelettet på steder med benmargsinfarkt.
Anemi
- Kronisk hemolytisk anemi
Det er som regel ikke anemien i seg selv som representerer de kliniske problemene ved sigdcelleanemi, da vevsoksygeneringen oftest er normal pga. HbS’s nedsatte oksygenaffinintet. Det anbefales ikke å transfundere ved pasientens steady state-Hb, da dette vil øke blodets viskositet og ikke øke oksygenavgiften til vevene vesentlig siden HbA har høyere oksygenaffinitet enn HbS. Det er vist en sammenheng mellom høy forekomst av stille hjerneinfarkter (SCI) og lav steady-state Hb, og også med gjentatte episoder med akutt anemi, forårsaket av f.eks. miltsekvestrering eller parvovirus B19 (Bernaudin mfl. 2015). - Megaloblastisk anemi
Pasienter med økt erythropoietisk aktivitet pga. kronisk hemolytisk anemi eller ineffektiv erythropoiese har økt behov for folsyre. Uten ekstra folsyretilskudd vil noen pasienter utvikle en megalobastisk erythropoiese pga. folsyremangel, og det er vanlig å anbefale et tilskudd av ca. 1 mg folsyre daglig. Derimot er det ikke vanlig med jernmangel på grunn av gjenbruk av jern fra hemolyserte erythrocytter. Ved dokumentert jernmangel skal denne behandles, men jerntilskudd ellers bør unngås. - Aplastisk krise
Ved hemning av benmargen uansett årsak vil Hb falle raskt (ca. 1 g/dL/dag) siden opprettholdelsen av en steady state-Hb er avhengig av sterkt forøket benmargsaktivitet. Aplastisk krise skyldes nesten alltid primærinfeksjon med parvovirus B19 (samme virus som gir Erythema infectiosum – ”fifth disease”). Viruset infiserer de erythroide forstadiene i benmargen og gir en mer eller mindre selektiv hemning av erythropoiesen. Infeksjonen er selvbegrensende (7–10 dager), men krever oftest en transfusjon. I regnerasjonsfasen etter benmargshemningen kommer det en kraftig retikulocytose, og i tidlig fase av denne (anemi, retikulocytose, kjernholdige røde i perifert blod, evt. hyperbilirubinemi) kan situasjonen feiltolkes som en ”hyperhemolytisk” krise. Infeksjonen gir hos de fleste varig immunitet. - Hyperhemolytisk krise
Betegnelsen refererer til en plutselig økning i hemolysen med forverret anemi til følge, til tross for persisterende retikulocytose. Det er kontroversielt hvorvidt tilstanden virkelig finnes (Vichinsky, UpToDate 2020), eller om det dreier seg om en udiagnostisert miltsekvestrering eller regenerativ fase etter aplastisk krise. Alternative forklaringer kan være en hyperhemolytisk tilstand etter en sen hemolytisk transfusjonsreaksjon, ledsagerfenomen ved vasookklusiv krise, eller en samtidig G6PD-mangel (glucose-6- fosfat-dehydrogenase-mangel), der en hemolytisk krise kan være forårsaket av en infeksjon eller medikamentutløst.
Kronisk organskade
- Det cardiovaskulære system
De fleste pasientene har systolisk ejeksjonsbilyd og forstørret hjerte sekundært til anemien. Normalt har sigdcellepasienter lavere arterielt blodtrykk enn alders-, kjønns- og etnisitetsmatchede kontroller i normalbefolkningen (Pegelow mfl. 1997). Hypertensjon hos sigdcellepasienter er så å si alltid renalt betinget. Hypertensjon øker risikoen for slag og er generelt assosiert med forkortet livslengde. Ved behandling av hypertensjon anbefales det å velge en ACE-hemmer (enalapril) som også reduserer proteinuri. Det er anbefalt å starte antihypertensiv behandling ved BT > 130/80 eller ved en økning med 15–20 mmHg fra basisverdi (Johnson 2005). - Nyreskade
Det hypertone miljøet i nyrenes medulla fremmer sickling som medfører redusert blodflow, og hypostenuri (lav urinosmolalitet) utvikles i tidlig barnealder. Det økte vanntapet gjennom nyrene gir tendens til dehydrering og forårsaker også nocturi og økt tendens til enurese. Andre nyremanifestasjoner ved sigdcelleanemi er hematuri (oftest mild, må utredes med henblikk på tumor), nefrotisk syndrom og uremi. Normalt har sigdcellepasienter lavere kreatinin enn andre på grunn av økt kreatininutskillelse i urinen, og kreatinin clearance er derfor dårlig egnet til å vurdere nyrefunksjonen. Serum-cystatin C sammen med måling av albuminutskillelse i urin er bedre egnet til å diagnostisere tidlig nyreskade (Alvarez mfl. 2006, Marouf mfl. 2006) - Retinopati
Pasienter med sigdcellesykdom har risiko for å utvikle retinopati (proliferativ og nonproliferativ), okklusjon av a. retinalis og netthinneløsning. Proliferativ retinopati er hyppigere ved SC-sykdom enn ved SS-sykdom (Downes mfl. 2005, Rosenberg og Hutcheson 2011). Laserbehandling kan bli aktuelt. Det er en viss tendens til spontan tilbakegang av proliferativ retinopati ved SCD, og utvikling til blindhet er sjelden (Downes mfl. 2005). - CNS
CNS-sykdom ved sigdcelleanemi opptrer dels i form av akutte katastrofer (omtalt tidligere), dels i form av stumme infarkter eller moyamoya-forandringer. Moyamoya beskriver et angiografisk bilde som består av progredierende stenose av store kar (den intrakranielle delen av a. carotis interna, a. cerebri media eller a. cerebri anterior) og dannelse av et nettverk av kollateraler. Disse kollateralene ser angiografisk ut som en røyksky, derav navnet moyamoya (japansk for tåkesky el. lign.) Moyamoyaforandringer disponerer for slag og bidrar sannsynligvis til nedsatt intellektuell kapasitet (Dobson mfl. 2002, Hogan mfl. 2005). - Skjelett – aseptiske/avaskulære nekroser
Avaskulær nekrose rammer hyppigst caput femoris og skyldes benmargsnekrose med etterfølgende benresorpsjon og kollaps. Tilstanden kan være symptomfattig, men gir ofte betydelige smerter, halte og innskrenket bevegelighet. Behandlingen er først og fremst avlastning for å tillate tilheling uten for stor grad av sammenfall. Det er ikke holdepunkter for at transfusjoner eller hydroksyurea har vesentlig effekt. Kirurgi i form av hofteprotese blir ofte nødvendig, men bør utsettes så lenge som mulig. - Lunge
- Astma
Det er etter hvert godt dokumentert at pasienter med sigdcelleanemi har økt prevalens av bronkial hyperreaktivitet og astma. Hvorvidt astma hos pasienter med sigdcelleanemi skyldes den unike patofysiologien ved sigdcellesykdommen eller de samme genetiske og miljømessige forholdene som ”vanlig” astma, er uavklart. Astma er en disponerende faktor for akutt chest syndrome og for pulmonal hypertensjon og må behandles aktivt etter vanlige retningslinjer for astma, inkludert inhalasjonssteroider og eventuelt leukotrienreseptorantagonister (Morris 2009, Newaskar mfl. 2011, Blake og Lima 2011). - Pulmonal hypertensjon
Mange pasienter med sigdcelleanemi utvikler kronisk lungesykdom/pulmonal hypertensjon med en rapportert hyppighet helt oppe i 32 %. Det er antatt at utviklingen av pulmonal hypertensjon har direkte sammenheng med hemolysen, da det også sees ved andre former for kronisk hemolytisk anemi (thalassemia intermedia, hereditær sfærocytose). Pulmonal hypertensjon rammer særlig voksne sigdcellepasienter.
- Astma
- Leggsår
Leggsår rundt anklene som følge av venøs insuffisiens forekommer hyppig, spesielt i alderen 15–20 år. Leggsår er hyppigere hos pasienter med lav Hb og sjeldnere ved høy HbF. Sårene utløses ofte av traumer. Tilhelingen er langsom, og mange sår kommer tilbake. Transfusjoner er ikke sikkert dokumentert å ha effekt. Hydroksyurea har vært forsøkt som behandling, men det er viktig å være klar over at leggsår også kan være en bivirkning til hydroksyureabehandling. De viktigste komponentene i behandlingen er god lokalbehandling (débridement, rensing, hvile, elastisk bandasje, eventuelt antibiotika). Sinksulfat (200 mg x 3) har gitt bedret tilheling i en kontrollert studie. - Fertilitet
Menn med SCD har ofte redusert fertilitet forårsaket dels av hypogonadisme, dels dårlig sædkvalitet og dels erektil dysfunksjon etter priapisme (Smith-Whitley 2014). Det er også holdepunkter for at fertiliteten blir ytterligere redusert ved bruk av hydroksyurea (DeBaun 2014). Kvinnelig fertilitet er dårlig undersøkt.
Behandling av sigdcellesykdom
Behandlingen må deles opp i to faser: Behandling av akutte tilstander og langtidsbehandling/- oppfølging. Oppfølgingen har som mål å avverge en del av komplikasjonene, dels ved opplæring av familiene, dels ved forebyggende behandling. For å oppnå dette er man avhengig av at diagnosen stilles så tidlig som mulig.
Oppfølging/generell behandling
- Første leveår
- Nøyaktig informasjon til foreldrene om sykdommens karakter og mulige komplikasjoner:
- Symptomer på dactylitt
- Symptomer og tegn på miltsekvestrering – foreldrene må instrueres i å palpere milten!
- Infeksjoner
- Når må barnet bringes til sykehus?
- Penicillinprofylakse (penicillin V) startes så tidlig som mulig i første leveår.
- 125 mg x 2 til ca. 3-årsalder
- 250 mg x 2 fra 3 år til 5-årsalder
Ved penicillinallergi: Erythromycin 10 mg/kg x 2
- Pneumokokkvaksine. Pneumokokkonjugatvaksinen (PKV13, Prevenar®) kan gis fra 2 måneders alder. Antall doser avhenger av når vaksineringen starter, se retningslinjer fra fabrikanten. Vaksinen er fra 2006 inkludert i det ordinære vaksineprogrammet.
- Hepatitt B-vaksine – inngår i det generelle barnevaksinasjonsprogrammet for alle barn født etter 1. november 2016
- Hepatitt A-vaksine
- Øvrig vaksineprogram som andre barn
- Jevnlige kontroller ved barnepoliklinikk, hver til hver annen måned. Kontroll av hematologiske parametre, generell klinisk vurdering med vekstutvikling, miltstørrelse, gjentagelse av tidligere gitt informasjon. Pasientens steady statehemoglobin manifesterer seg ikke før i 2. levehalvår. 1.8. Åpen dør på barneavdeling ved symptomer på sykdom
- Nøyaktig informasjon til foreldrene om sykdommens karakter og mulige komplikasjoner:
- Etter første leveår
- Kontroller ved barnepoliklinikk hver 3.–6. måned ved behov. Fortsatt åpen dør til barneavdeling ved akutt sykdom. Generell klinisk vurdering ved hver kontakt, gjentatt informasjon.
- Blodprøver: Hematologisk status hver gang, også når det ikke er noen problemer. Det er svært viktig å fastslå pasientens steady state-Hb, så man har et utgangspunkt for vurdering i en akutt situasjon. Elektrolyttstatus, kreatinin, transaminaser
- Oksygenmetning – viktig å kjenne steady state-oksygenmetning for å oppdage eventuell desaturasjon
- Nattlig metningsmåling hvis steady state-metning er < 95 % eller ved snorking
- Urinprøve: albumin, blod 1–2 ganger årlig
- Blodtrykkskontroll årlig
- Vaksinasjoner: Pneumokokkpolysakkaridvaksine (PPV23, Pneumovax®) ved 2-årsalder og deretter ca. hvert 5. år etter måling av antistofftiter. Årlig influensavaksine. Vanlig vaksineprogram for øvrig
- Ved reise til endemiske områder (Afrika/Saudi-Arabia): Meningokokkvaksine (ACWY) og malariaprofylakse (Dick 2008)
- Kosttilskudd
- Folsyre ca. 1 mg daglig
- Generelt vitamintilskudd – pasientene er nesten alltid svært mørkhudede og har derfor økt risiko for vit. D-mangel og rakitt når de bor i Norge.
- Omega-3-fettsyrer – det ser ut til at omega-3-fettsyrer kan redusere frekvensen av smertefulle kriser (sammenlignet med olivenolje) pga. en generell antitrombotisk effekt, uten å gi økt blødningstendens (Tomer et al 2001, Okpala 2005). Noen veldefinerte retningslinjer for fettsyretilskudd har vi ikke sett, men det er fornuftig å anbefale pasientene å ta tran eller trankapsler, både av hensyn til vitaminene og omega-3-fettsyrene.
- Mineraler. Sigdcellepasienter har tendens til lave verdier for serum-sink og serum-magnesium, noe som forsterkes ved behandling med hydroksyurea. Det er vist at sink-tilskudd bedrer tilhelingen ved leggsår selv om S-sink ikke er lavere enn hos pasienter uten leggsår.
- Spesiell oppfølging
- Transcraniell Doppler-undersøkelse (TCD) fra 2- til 16-årsalder. Årlig ved normalt resultat, hyppigere hvis patologisk verdi eller grenseverdi (UK standards). Normalt: < 1.7 m/s, grenseverdi 1.7–2.0 m/s, patologisk ≥ 2.0 m/s. Ved to målinger ≥ 2.0 m/s må foreldrene informeres om den økte risikoen for slag, og det må gis tilbud om transfusjoner som primær slagprofylakse.
Siden det har forekommet cerebralt infarkt i intervallet mellom de to målingene, anbefaler mange å starte regelmessige transfusjoner etter bare én patologisk måling.
Hvis Hb på undersøkelsestidspunktet samtidig er uventet lav, anbefales det likevel å vente forutsatt at man gir en enkelt transfusjon. Deretter gjentas TCD etter 3 måneder, med Hb i steady state-området for den aktuelle pasienten, før endelig beslutning tas (Bernaudin mfl. 2011, Adams mfl. 2016). - Nevropsykologisk vurdering med henblikk på behov for ekstra hjelp i skolen. Dette er et følsomt område, og det bør tilbys som del av den generelle oppfølgingen, i hvert fall 1–2 ganger i løpet av oppveksten med oppfølging om nødvendig (Wills KE mfl. 2010). Dette er ikke satt i system hos oss, men kan ivaretas ved årvåkenhet overfor generelt funksjonsnivå og skoletilpasning.
- Årlig øyelegekontroll fra skolealder med tanke på retinopati, spesielt viktig for pasienter med HbSC.
- Lungefunksjonskontroller hos pasienter med astma og/eller gjentatte ACS.
- Cardiologisk oppfølging, spesielt viktig for barn med astma eller andre tegn på lungesykdom og for voksne.
- Transcraniell Doppler-undersøkelse (TCD) fra 2- til 16-årsalder. Årlig ved normalt resultat, hyppigere hvis patologisk verdi eller grenseverdi (UK standards). Normalt: < 1.7 m/s, grenseverdi 1.7–2.0 m/s, patologisk ≥ 2.0 m/s. Ved to målinger ≥ 2.0 m/s må foreldrene informeres om den økte risikoen for slag, og det må gis tilbud om transfusjoner som primær slagprofylakse.
- Sentral oppfølging
Det anbefales årlig kontroll ved spesialavdeling med særlig kompetanse innen hemoglobinsykdommer.
Smertebehandling
De fleste smertefulle episoder kan behandles hjemme med rikelig drikke og analgetika. Aktuelle medikamenter til hjemmebehandling er paracetamol, NSAIDs (ibuprofen eller diklofenac er mest brukt) og paracetamol/codein. Når pasienten kommer til sykehus, er det fordi smertebehandlingen hjemme ikke er tilstrekkelig.
For å yte optimal smertebehandling må man ha et hensiktsmessig evalueringsredskap. En visuell analog smerteskala (VAS-skala [tall] eller modifisert Bieri-skala [bilder]) er et nyttig hjelpemiddel:
Målet for smertebehandlingen er smertefrihet uten respirasjonsdepresjon. Det må som hovedregel brukes en kombinasjon av perifert og sentralt virkende analgetika. Husk tett oppfølging med henblikk på effekt av behandlingen, respirasjon og generell vurdering!
- Væske – korreksjon av dehydrering, deretter vedlikeholdsbehov, mer ved feber. Nøyaktig monitorering av væskeregnskap, unngå overhydrering som disponerer for atelektase og utvikling av akutt chest syndrome.
- Paracetamol 15–20 mg/kg x 4–6 p.o. (max. døgndose 100 mg/kg), evt. i.v. 15 mg/kg x 4 for barn ≥ 10 kg, 7.5 mg/kg x 4 ved vekt < 10 kg
- Et NSAID-preparat
- Ibuprofen ca. 10 mg/kg x 3 eller
- Diklofenac 1 mg/kg x 2–3 (godkjent for barn > 6 år)
- De fleste har fått codein hjemme før innleggelsen, og det er derfor som regel riktig å starte rett på parenteral morfin hvis paracetamol/codein har vært utilstrekkelig før innleggelsen3
- Startdose: 0.1–0.15 mg/kg (spedbarn: 0.05 mg/kg) i.v. (evt. s.c. i påvente av i.v. tilgang4)
- Hvis utilstrekkelig effekt etter 20–30 minutter: gi tillegg av 25–50 % av den opprinnelige dosen. OBS respirasjon!
- Behandlingen må gis som fast forordning, ikke ”ved behov”. Man tilstreber å unngå gjennombruddssmerte.
- For de fleste vil kontinuerlig infusjon av morfin være den administrasjonsformen som er lettest å styre, med mulighet for selvadministrering av bolusdoser (PCA – ”patient controlled analgesia”) ved behov (aktuelt for barn > ca. 7 år). Etter en initial bolus på 0.1 mg/kg settes det opp en infusjon med 10–40 μg/kg/time (hvis pasienten har fått gjentatte bolusdoser det foregående døgnet, kan administrert totaldose dividert på antall timer brukes som utgangspunkt for timedosen når man skifter til pumpe). I tillegg til grunndoseringen kan pasienten få bolusdoser på ca. 15–30 μg/kg (0.015–0.030 mg/kg), inntil 3–4 ganger pr. time. Hvis det er behov for mange bolusdoser, er grunndoseringen for lav og må økes.–
NCA (”nurse controlled analgesia”) kan brukes til mindre barn som ikke er i stand til å styre smertepumpen selv. Prinsippet er det samme – en grunndosering på 10–20(–40) μg/kg/time etter en initial bolusdose på 0.1 mg/kg. - Eventuelt adjuvantia:
- Antihistaminer
- Antidepressiva
- Benzodiazepiner
- Antiepileptika
3 Flere forfattere anbefaler tramadol som et ikke-respirasjonshemmende smertestillende medikament velegnet til behandling av SCD-smerter. Petidin bør ikke brukes (Glassberg mfl. 2011)
4 Intranasal fentanyl er også beskrevet som første intervensjon ved smertefulle kriser, 2 µg/kg, max. 100 µg, som engangsdose, for å unngå forsinkelse i smertebehandlingen (Fein mfl. 2016)
Barn på smertepumpe må ha nøye overvåkning av respirasjon og oksygenmetning og gjentatt evaluering av smertesituasjonen (VAS-skala), kontinuerlig til å begynne med, sjeldnere etter hvert som situasjonen snur. Ved tegn på respirasjonshemning kan det bli nødvendig med forsiktig reversering med nalokson, 1–3 μg/kg. Dosen kan gjentas med 2–3 minutters intervall til ønsket respirasjonsmønster/våkenhet.
Når tilstanden bedres, er det vanligvis lett å titrere seg ned i morfindose ved å redusere hastigheten og seponere i løpet av et par dager. Hvis episoden har vart lenge, trenger man lengre avvenningstid, eventuelt en overgangsfase med peroral behandling.
Infeksjonsbehandling
Det er indikasjon for antibiotikabehandling ved febrile sigdcellekriser hvis pasienten er i generelt nedsatt allmenntilstand, har respiratoriske symptomer eller andre spesifikke infeksjonssymptomer. Det bør gis bredspektret dekning etter generelle retningslinjer (ampicillin/gentamycin er 1.valg, eventuelt cefotaxim eller et annet 3. generasjons cefalosporinpreparat [ceftriakson er oftest anbefalt internasjonalt pga. lang halveringstid]).
Ved nedre luftveisinfeksjoner må antibiotikadekningen inkludere et makrolid med tanke på mycoplasma.
Transfusjoner ved sigdcelleanemi
Generelt skal man være restriktiv med transfusjoner ved sigdcellesykdom. Pasienter med til dels svært lav steady state-Hb har normal vevsoksygenering pga. HbS’s reduserte O2- affinintet, og en rekke av komplikasjonene ved sigdcelleanemi er hyppigere hos pasienter med høy steady state-Hb. Transfusjoner er forbundet med komplikasjoner, først og fremst immunisering/transfusjonsreaksjoner, risiko for infeksjoner og jernoverskudd. Alle komplikasjonene øker i hyppighet med antall transfusjoner. Immunisering er hyppig fordi pasientene er av en annen etnisk gruppe enn de fleste blodgiverne, og dette kan gi opphav til både akutte og forsinkede transfusjonsreaksjoner. Det er derfor svært viktig med utvidet blodtyping før første transfusjon, og det må av samme grunn bare benyttes filtrerte blodprodukter. Transfusjonsoverførte infeksjoner er nå svært sjeldne i vår del av verden, men det er urealistisk å tenke seg at den risikoen kan oppheves fullstendig. Etter et stort antall transfusjoner vil pasientene få et jernoverskudd, og de trenger jernchelerende behandling som andre pasienter med transfusjonsbetinget jernoverskudd.
Transfusjoner har som mål å bedre oksygeneringen og viskositeten, og å redusere fraksjonen HbS. Transfusjoner er enten aktuelle som akuttbehandling i forbindelse med sigdcellekriser, eller som et regelmessig transfusjonsprogram som primær- eller sekundærprofylakse mot komplikasjoner av sigdcellesykdommen, først og fremst slag og akutt chest syndrome. Det er ikke indisert med transfusjon for å heve pasientens steady state-Hb (Serjeant 2003). Transfusjoner kan gis enten som en enkel påfyllingstransfusjon eller som utskiftningstransfusjon, eventuelt som en kombinasjon av disse to måtene.
Påfyllingstransfusjon kan heve pasientens Hb-nivå og bedre oksygeneringen, men hvis Hb kommer over 10 g/dL, vil viskositeten øke, noe som er uheldig av reologiske hensyn. For å stoppe en pågående sickling-prosess må man tilstrebe å senke pasientens HbS-nivå til under 20–30 %, og man må da gjøre utskiftningstransfusjon for å komme raskt ned i HbS-fraksjon og for å unngå problemer med for høy viskositet.
Enkel transfusjon
Det er sjelden indisert å transfundere til høyere Hb-nivå enn pasientens steady state-Hb, og generelt ikke høyere enn til Hb ca. 10 g/dL (Davies SC og Olatunji 1995, Howard 2016). SAG-blod ved blodbanken i Oslo har en hematokrit på 0.50–0.60 (Thomas Larsen Titze, personlig meddelelse). Man kan beregne transfusjonsvolumet etter følgende formel, der HbT er ønsket Hb (T for ”target”), HbS er start-Hb og k er en konstant:
Transfusjonsvolum (ml) = (HbT – HbS) x vekt (kg) x k
Ved bruk av SAGM-blod med Hct 0.60 er k = 5 (Davies P mfl. 2007).
Hvis Hct i det transfunderte blodet avviker fra 0.60, blir transfusjonskonstanten 3/Hct.
Ved Hct i transfundert blod 0.54 (som blodbanken ved OUS angir) blir k = 5.56.
Hb kan om nødvendig kontrolleres 1–2 timer etter avsluttet transfusjon.
Utskiftningstransfusjon
En utskiftningstransfusjon kan være partiell eller komplett og kan foregå enten som en manuell utskiftningstransfusjon eller som erythrocyttaferese. Ved manuell utskiftningstransfusjon bør man helst ha en kanyle i hver arm. Ved komplett utskiftningstransfusjon beregner man å skifte ca. 1.5–2 ganger pasientens blodvolum.
Blodvolumet beregnes vanligvis til 80–90 ml/kg hos nyfødte, gradvis avtagende til 70 ml/kg hos voksne. Ofte bruker man 85 ml/kg hos ”små” barn (< 20 kg), 70 ml/kg hos større barn og voksne (Swerdlow 2006).
Hvis man har tid, kan blodbanken lage blod med ønsket Hct til utskiftning (ca. 0.30). Ellers må man bruke SAGM-blod som beskrevet nedenfor.
Fremgangsmåte ved manuell utskiftning med SAG:
SAGM-blod har Hct på ca. 0.54. Har man blandingsforhold SAGM-blod : NaCl/plasma = 1:1 gir en da en blanding med i snitt Hct = 0.27 til pasienten. Om en bruker forholdstallet SAGM-blod : NaCl/plasma = 2:1 gir en pasienten en blanding med Hct = 0.36.
Ut fra dette kan man for enkelthets skyld si at hvis utgangspunktet er en målt Hct > 0.30 (f.eks. hvis man har startet med en topptransfusjon i påvente av utskiftningen), kan man. gi SAG og NaCl/plasma annen hver gang, mens hvis man starter med Hct < 0.30, kan forholdet mellom SAG og plasma/NaCl være 2:1.
- Beregn utskiftningsvolum, vanligvis 1.5 (– 2) x pasientens blodvolum (se ovenfor for beregning av blodvolumet)
- Ut fra målt Hct før start velger en enten 1/3 av dette volumet som SAGM-blod (om målt Hct > 0.30) eller 2/3 av volumet som SAGM-blod (om målt Hct før start var < 0.30)
- En kan tappe og infundere samtidig, og da må en bruke samme dråpetakt inn /ut. Oftest skiftes det i repriser.
- Det skiftes i repriser med tapping og deretter infusjon (av enten SAGM-blod eller NaCl/plasma) i samme volum ut som inn:
- Tapp 3.5–5 ml blod/kg kroppsvekt. Bruk 5–10 minutter på tappingen, og tilsvarende på infusjon
- Erstatt det uttatte volumet med
- enten SAGM-blod og NaCl/plasma annen hver gang hvis målt Hct før start var > 0.30
- eller SAGM-blod to ganger og deretter én gang NaCl/plasma hvis Hct før start var < 0.30
- Gjenta tapping/infusjon til totalt ønsket volum er skiftet
- Underveis i prosessen bør man kontrollere Hb, tr.c. og INR/APTT.
Ved tr.c < 30–50: vurder trombocyttransfusjon
Ved signifikant stigende INR/APTT (f.eks. ≥ 50 %): gi større andel plasma i
NaCl/plasma-delen du gir til pasienten.
- I steady state-situasjon kan man skifte raskere, og det kan ofte være tilstrekkelig med en partiell utskiftning:
- Infunder 5 ml/kg fysiologisk saltvann over ca. 10 minutter
- Tapp 10(–15) ml/kg blod over 15–20 minutter (obs. symptomer på hypovolemi)
- Transfunder 15 ml/kg SAG
Som partiell utskiftningstransfusjon som del av et kronisk transfusjonsprogram er dette tilstrekkelig, kan evt. gjentas.
- Etter avsluttet utskiftning må pasientens hemoglobin/hematokrit og HbS-fraksjon kontrolleres. Utskiftningstransfusjoner må iblant gjentas, for eksempel ved behandling av slag eller ACS. Ved regelmessige transfusjoner som slagprofylakse må man ofte gjøre utskiftningstransfusjon innimellom for å hindre at Hb kommer for høyt. Det vil også redusere jernbelastningen, og av den grunn velger mange erythrocyttaferese som standard ved indikasjon for regelmessige transfusjoner (Ullrich mfl. 2008, Matevosyan mfl. 2012)
Transfusjonsindikasjoner
- Raskt fall i Hb med mer enn ca. 2 g/dL fra steady state-Hb – påfyllingstransfusjon
✓ Akutt miltsekvestrering
✓ Aplastisk krise - Akutt chest syndrome – utskiftningstransfusjon ved deoksygenering/respirasjonssvikt. Gi en vanlig påfyllingstransfusjon først (pga. Hb-fall), deretter utskiftning hvis ikke påfyllingstransfusjonen bedrer oksygeneringen tilstrekkelig.
- Akutte nevrologiske syndromer – utskiftningstransfusjon
✓ Slag
✓ Okklusjon av a. retinalis - Primær- og sekundærprofylakse mot slag (se avsnittet om cerebralt infarkt)
- Før elektiv kirurgi. Det er vanlig å anbefale en enkel transfusjon for å heve Hb preoperativt til ca. 10 g/dL, bortsett fra ved helt enkle inngrep (f.eks. testisretensjon, hernie). Det er ikke vist at preoperativ utskiftningstransfusjon gir færre komplikasjoner enn en enkel transfusjon.
- Før planlagte røntgenundersøkelser med hyperosmolære kontrastmidler
Mer omdiskuterte indikasjoner er priapisme, leggsår, svangerskap.
Komplikasjoner ved transfusjoner
- Immunisering/transfusjonsreaksjoner
- Transfusjonsoverførte infeksjoner
- Jernopphopning
Transfusjonsreaksjoner
Pasienter med sigdcelleanemi som behandles med transfusjoner, utvikler alloantistoffer mot røde blodlegemer med en hyppighet på 5–50 %, først og fremst pga. forskjellig etnisistet mellom pasientgruppen og blodgiverne. Antistoffene kan være transitoriske og derfor vanskelige å oppdage. Hemolytiske transfusjonsreaksjoner skyldes oftest transfusjon av feil blod til feil pasient, eller uoppdaget alloimmunisering.
Hemolytiske transfusjonsreaksjoner kan være akutte eller forsinkede. Symptomer kan være feber, frostanfall, tachycardi eller cardiorespiratorisk kollaps, eventuelt symptomer som ved en vasookklusiv krise. Direkte antiglobulintest (DAT, tidligere Coombs’ test) kan være positiv eller negativ (Talano mfl. 2003, Wanko and Telen 2005).
De akutte hemolytiske transfusjonsreaksjonene gir symptomer i løpet av minutter til timer og er derfor lette å oppdage. De forsinkede transfusjonsreaksjonene skyldes en anamnestisk immunrespons hos en som tidligere er immunisert. Disse er vanskeligere å identifisere, spesielt hvis de klinisk arter seg som en smertefull krise, eller hvis DAT er negativ. En må mistenke en transfusjonreaksjon hvis pasienten presenterer seg 4–10 dager etter en gjennomgått transfusjon med Hb-fall og tegn på økt hemolyse (forhøyet bilirubin og LD, nedsatt haptoglobin). DAT er som nevnt ofte negativ, og mange har lave retikulocytter til tross for uttalt hemolyse. Noen ganger vil en hemolytisk transfusjonsreaksjon utløse en autoimmun hemolyse samtidig, slik at hemoglobin faller til lavere verdi enn den opprinnelige pretransfusjonsverdien – hyperhemolyse.
Et slikt syndrom med forsinket hemolytisk transfusjonsreaksjon/hyperhemolyse kan behandles med steroider, intravenøst immunglobulin og eventuelt rituksimab (monoklonalt antistoff mot CD20) som vil destruere B-lymfocyttene og dermed avbryte immunresponsen.
Jernopphopning
Pasienter som får hyppige transfusjoner, vil etter hvert samle seg opp et jernoverskudd. Siden de fleste pasienter med sigdcelleanemi kun får sporadiske transfusjoner, er det sjelden behov for jernchelerende behandling, men pasienter i et regelmessig transfusjonsprogram vil etter hvert få behov for jernchelerende behandling som en pasient med thalassemia major. Ved bruk av utskiftningstransfusjoner/erythrocyttafereser, helt eller delvis, vil man unngå eller redusere problemet med jernopphopning. Gjennomføringen av jernchelerende behandling er utførlig omtalt i handlingsprogrammet for thalassemi.
Sykdomsmodifiserende medikamenter
Sigdcellesykdom kan helbredes ved hematopoietisk stamcelletransplantasjon, men de fleste pasienter med sykdommen har ikke tilgang til forlikelig donor. Det har derfor nå i mange år vært investert mye i forskning på medikamenter som vil kunne modifisere sykdommens naturlige forløp. De mest aktuelle medikamentene pr. mai 2020 er følgende:
- Hydroksyurea (hydroksykarbamid, HU)
- L-glutamin
- Voxelotor
- Crisanlizumab
Hydroksyurea er nå standard behandling for barn med SCD og vil bli beskrevet i detalj, mens de øvrige nevnt ovenfor er kommet til de siste årene og vil omtales mer summarisk.
Hydroksyurea (hydroksykarbamid)
Hydroksyurea (HU) har i mange år vært enerådende som sykdomsmodifiserende medikament ved sigdcellesykdom. Hydroksyurea er en antimetabolitt som øker syntesen av HbF både hos friske personer og hos pasienter med sigdcelleanemi. Det at pasienter med sigdcelleanemi og en høy fraksjon HbF som regel har mildere sykdomsforløp enn pasienter med lav fraksjon HbF, var bakgrunnen for kliniske forsøk med behandling av pasienter med sigdcelleanemi med HU fra 1980-tallet. Fra midten av 1990-tallet er det publisert en rekke studier på behandling av sigdcellepasienter, voksne og etter hvert barn, med hydroksyurea (Charache mfl. 1995, Scott mfl. 1996, Olivieri mfl. 1998, Kinney mfl. 1999, Ferster mfl. 2001, Hankins mfl. 2005, Wang mfl. 2011), og de har nokså entydig vist reduksjon av antall og alvorlighetsgrad av smertefulle kriser og akutt chest syndrome, redusert transfusjonsbehov og redusert behov for hospitalisering. Effekten ser ut til å være varig (Ferster mfl. 2001, Zimmerman mfl. 2004, Hankins mfl. 2005, Ware 2010).
Hematologisk ser man hos de fleste økt Hb-verdi, økt fraksjon HbF, økt MCV og redusert antall retikulocytter, leukocytter, nøytrofile granulocytter og trombocytter. Hb-økningen skyldes redusert hemolyse, noe som bekreftes ved fall i ukonjugert bilirubin og LD. De øvrige hematologiske effektene er som ventet av et medikament som virker benmargshemmende.
HU har effekt på pasienter med HbSS, HbSC og HbSβ-thalassemi, og det er flere studier som indikerer at effekten kanskje er best ved HbSβ-thalassemi, forklart ved at økt mengde γ-kjeder ikke bare hindrer sickling-prosessen, men også nøytraliserer overskuddet av α-kjeder og derved den ineffektive erythropoiesen (Musallam mfl. 2013).
Etter hvert som observasjonstiden for pasienter behandlet med HU er økt, er det dokumentert markert nedgang i dødelighet hos sigdcellepasienter behandlet med hydroksyurea, både voksne og barn. En langtidsstudie av 299 amerikanske voksne med sigdcelleanemi behandlet med HU hadde komplette oppfølgingsdata på 233 med en observasjonstid på inntil 9 år (Steinberg et al 2003), og den viste en reduksjon i dødelighet på 40 % ved bruk av HU. Den samme pasientpopulasjonen ble fulgt opp videre i inntil 17.5 år med henblikk først og fremst på behandlingskomplikasjoner, organdysfunksjon og død av alle årsaker (Steinberg mfl. 2010). Studien viste at total dødelighet var redusert hos pasienter som hadde brukt HU i lang tid, uten alvorlige bivirkninger. Det var ingen økt insidens av infeksjoner eller maligne sykdommer og ingen påvist teratogenisitet. Tilsvarende har en stor brasiliansk studie av barn med sigdcellesykdom vist betydelig redusert mortalitet (87 % reduksjon) ved HU-behandling sammenlignet med gruppen som ikke fikk HU, til tross for at barna som fikk HU, hadde mer alvorlig fenotype enn de ubehandlede (Lobo mfl. 2013).
Til å begynne med ble effekten av HU oppfattet som kun formidlet gjennom økningen av HbF, men HU har også effekt gjennom reduksjon i antall nøytrofile granulocytter, ved frigjøring av NO, reduksjon av erythrocyttenes intracellulære dehydrering og adhesivitet til endotel (Davies SC and Gilmore 2003, Heeney og Ware 2010).
I amerikanske studier har man tilstrebet å trappe opp HU-dosen til maksimal tolerert dose (MTD) vurdert etter antall nøytrofile granulocytter, opp til 35 mg/kg/dag, mens man i Europa som regel har styrt doseringen etter effekt og gitt minste dose som gir klinisk effekt (Okpala 2005). Argumenter for å øke dosen til MTD også etter at klinisk effekt er oppnådd, er dels at en moderat nøytropeni reduserer den inflammatoriske prosessen som er en viktig komponent i de vasookklusive krisene, dels at en maksimal HbF-respons gir redusert hemolyse og derved høyere Hb, dels rapporter om organsparende effekt av HU (Ware 2010, Heeney og Ware 2010). Generelt tåles HU godt, og infeksjonskomplikasjoner er svært sjeldne. Det er ikke rapportert vekstforstyrrelser eller kognitive forstyrrelser hos barn på HU, selv ikke ved behandlingsstart i første leveår og langvarig behandling (Hankins mfl. 2005, 2010).
HU-behandling av barn med SCD brukes nå stadig mer, selv om det totalt antagelig fremdeles er et underforbruk. Expert Panel Report i USA anbefaler å tilby HU til alle barn diagnostisert med SCA fra 9-månedersalder (2014). De presiserer at det dreier seg om et tilbud som må diskuteres med hver enkelt familie. Andre gir HU til alle asymptomatiske barn med SCA fra 5-årsalder som ”standard of care” (Kassim og DeBaun 2014), men er også åpne for å starte tidligere. Den første studien som beskriver sykdomsforløpet for en pasientgruppe behandlet med HU fra før fylte 2 år og minimum 15 år sammenhengende (n=8), viste persisterende hematologisk effekt uten signifikant toksistet, normal vekst og utvikling inkludert tidspunkt for pubertet, og ellers svært få vasookklusive episoder og minimalt behov for transfusjoner (Hankins mfl. 2014).
En stor bekymring ved langtidsbehandling av barn med HU har vært mulig carcinogen/ leukemogen effekt. Det ble tidlig rapportert to tilfeller av malignitet hos barn behandlet med HU for sigdcelleanemi (et tilfelle av Philadelphia-kromosom positiv ALL etter 7 ukers behandling og et tilfelle av Hodgkins lymfom etter 6 måneders behandling), men på grunn av kort eksponeringstid ble disse ansett som uavhengige av HU-behandling. Det er ikke vist økt forekomst av maligne sykdommer hos voksne SCD-pasienter behandlet med HU i inntil 17.5 år sammenlignet med ubehandlede (Steinberg mfl. 2010). Men HU er potensielt mutagent, og det gir nedsatt evne til DNA-reparasjon. Etter flere tiårs bruk av HU til behandling av sigdcellesykdom er det ikke påvist økt forekomst av kreftsykdommer sammenlignet med en normalbefolkning.
Det er rapportert teratogenisitet av hydroksyurea i noen gamle studier, og alle seksuelt aktive som behandles med HU, anbefales å bruke sikker prevensjon. Det er dog beskrevet fullførte graviditeter hos HU-behandlede pasienter, uten at det har vært sett misdannelser hos barna (Davies SC og Gilmore 2003, Steinberg mfl. 2010).
Indikasjoner for behandling med hydroksyurea Etablerte:
Omdiskuterte:
|
Dosering av HU
|
Monitorering av HU-behandling
|
Bivirkninger av HU
|
Det har etter hvert vist seg at manglende effekt hos barn som faktisk tar medisinen, antagelig så å si ikke forekommer (Ware 2010).
Hydroksyurea ble godkjent av FDA (Food and Drug Administration) til behandling av sigdcellesykdom hos voksne i USA i 1998 og for barn i 2017. I Europa ble HU godkjent av EMA (European Medicines Agency) ved indikasjonen sigdcelleanemi for voksne og barn over 2 år i juni 2007 (preparatet Siklos® som finnes i tabletter på 100 og 1000 mg – ikke i salg i Norge) (https://www.ema.europa.eu/en/medicines/human/EPAR/siklos).
I Norge er to preparater med HU registrert (2016), Hydroxyurea medac® og Hydrea® som begge kommer i kapsler på 500 mg, men ingen av disse har sigdcelleanemi som registrert indikasjon. Det kan også lages mikstur på 100 mg/mL som har lang holdbarhet i romtemperatur (Heeney mfl. 2004), og det kan importeres en kommersiell mikstur på 100 mg/mL på registreringsfritak. Sykehusapoteket på Ullevål har også vært behjelpelig med å lage kapsler i forskjellige styrker etter behov.
L-glutamin
Aminosyren L-glutamin er substrat for produksjon av NAD (nikotinamid adenin nukleotid) og kan påvirke erythrocyttenes oksydative tilstand gjennom endring i NAD/NADH-balansen. Redusert NAD (NADH) har en viktig funksjon ved SCD for å redusere oksydativ skade av erythrocyttene, og det er vist at tilførsel av L-glutamin bedrer NAD’s redoks-potensial ved SCD.
En randomisert studie med 230 deltagere fra 5-årsalder (156 som fullførte studien) viste at L-glutamin i dosering 0.3 g/kg delt på to daglige doser (maks 30 g daglig) viste at gruppen som fikk L-glutamin hadde færre smertefulle episoder, færre og kortere sykehusinnleggelser og færre tilfeller av akutt chest syndrome enn placebogruppen (Niihara mfl. 2018). Effekten var uavhengig av samtidig bruk av hydroksyurea. På bakgrunn av denne studien (og forberedende studier) ble L-glutamin FDA-godkjent i 2017 for voksne og barn over 5 år. Det er anbefalt at L-glutamin kan brukes som et alternativ eller tillegg til HU i de få tilfellene der HU ikke har tilstrekkelig effekt, eller til pasienter som ikke tolererer HU, men det understrekes at dokumentasjonen foreløpig er sparsom, og at det registrerte preparatet er svært kostbart (Cieri-Hutcherson mfl. 2019, Vichinsky, UpToDate 2020).
Voxelotor
Voxelotor er et molekyl som binder seg reversibelt til α-kjeden i HbS-molekylet, endrer den allosteriske konfigurasjonen og øker affiniteten til oksygen, slik at den endrede HbSfraksjonen stabiliseres i oksygenert tilstand. Siden oksygenert HbS ikke polymeriserer, kan man forvente at det å øke fraksjonen oksygenert HbS til en viss grad vil beskytte erythrocyttene mot sickling. Det er vist at en binding av HbS til voxelotor i størrelsesorden 20–30 % hemmer sickling og reduserer hemolyse uten å kompromittere vevsoksygeneringen (Hutchaleelaha mfl. 2018). Dette harmonerer med at dobbelt heterozygote individer med HbS og en variant av hereditær persisterende forhøyet HbF (HPFH – delesjonal HPFH) som har en pancellulær HbF-fraksjon på 20–30 %, er tilnærmet symptomfrie av sin SCD. Dette er bakgrunnen for at man tilstreber ca. 20–30 % binding av HbS til voxelotor (Hutchaleelaha mfl. 2018, Howard mfl. 2019, AlDallal 2020). Behandling med voxelotor gir økt levetid av erythrocyttene, redusert blodviskositet, redusert hemolyse og økt Hb-nivå. Behandlingen er peroral og tas i form av én daglig dose.
En randomisert internasjonal multisenterstudie (GBT-HOPE) som sammenlignet to dosenivåer av voxelotor (hhv. 900 mg og 1500 mg daglig) med placebo hos totalt 274 pasienter med SCD viste signifikant Hb-stigning og reduksjon i hemolyseparametrene, redusert hyppighet av forverret anemi, men ikke signifikant reduksjon i antall vasookklusive episoder etter 24 ukers behandling (Vichinsky mfl. 2019). Økt Hb og reduksjon i hemolyseparametrene opptrådte etter 2 ukers behandling og var deretter stabile. Effekten var størst i 1500 mg-gruppen. Det ble ikke observert reduksjon i fysisk kapasitet eller noe tegn på nedsatt vevsoksygenering. På bakgrunn av denne studien ble voxelotor godkjent til behandling av SCD for voksne og barn over 12 år av FDA i november 2019. Det pågår videre studier av langtidsbehandling med voxelotor.
Crizanlizumab
Crizanlizumab er et monoklonalt antistoff mot P-selectin, et adhesjonsmolekyl som frigjøres fra endotelceller og trombocytter ved inflammasjon og derved setter i gang den vasookklusive prosessen ved sigdcellesykdom. Den første publiserte studien av behandling med crizanlizumab ved SCD (Ataga m.fl. 2016) viste at crizanlizumab ga redusert forekomst av smertefulle kriser sammenlignet med placebo, også hos pasienter som samtidig brukte hydroksyurea. Graden av hemolyse ble ikke påvirket. I en forlengelse av denne studien ble det vist at antall pasienter som oppnådde langvarige perioder uten vasookklusive episoder i det hele tatt, økte (Kutlar mfl. 2019).
Crizanlizumab gis som månedlige intravenøse infusjoner, og i den refererte studien var effektiv dose 5 mg/kg. Crizanlizumab ble på bakgrunn av denne studien godkjent av FDA for pasienter med SCD (alle genotyper) over 16 år i november 2019. Det pågår videre studier.
Allogen stamcelletransplantasjon
Sigdcelleanemi kan helbredes ved hematopoietisk stamcelletransplantasjon (SCT). Hensikten med SCT er å forhindre morbiditet og mortalitet på grunn av sykdommens komplikasjoner, først og fremst cerebralt infarkt og akutt chest syndrome, men også invalidiserende smerter og kronisk organskade. På grunn av sykdommens uforutsigelige forløp (Steinberg 2005) er det vanskelig å finne de ”riktige” kandidatene for SCT før etter at en alvorlig komplikasjon har funnet sted. Etter som erfaringen med hydroksyureabehandling øker, vil de fleste anbefale et behandlingsforsøk med HU før en evt. SCT.
Komplikasjonsraten ved SCT hos sigdcellepasienter har vært relativt stor, med en rapportert prosedyrerelatert dødelighet opp mot 10 %. Spesielle problemer knyttet til disse transplantasjonene er rejeksjon og nevrologiske komplikasjoner (slag, PRES – ”posterior reversible encephalopathy symdrome”)(Switzer mfl. 2006, Robinson og Fuchs 2016). Men resultatene etter SCT med forlikelig søskendonor har blitt betydelig bedret de siste årene med < 5 % transplantasjonsrelatert mortalitet og rundt 90 % sykdomsfri overlevelse, og indikasjonene for SCT er derfor blitt utvidet (Fitzhugh mfl. 2014). Det diskuteres nå også å utføre SCT hos foreløpig asymptomatiske pasienter (Sheth mfl. 2013, Nickel mfl. 2014).
Det er bare et mindretall av pasientene som har en aktuell familiedonor. Bruk av alternative donorer utredes også, men har foreløpig ikke vært noen stor suksess (Arnold mfl. 2016).
I Norge er det foreløpig (mai 2020) ikke utført SCT på pasienter med sigdcelleanemi.
Eksperimentell behandling
Nitrogenoksyd (NO)-inhalasjoner
Intravasal hemolyse ved sigdcelleanemi og andre hemolytiske anemier medfører økt mengde fritt hemoglobin i plasma, noe som gir nedsatt konsentrasjon av NO og redusert endogen produksjon av NO fra arginin. Redusert konsentrasjon av NO gir vasokonstriksjon og trombocyttaggregasjon med derav følgende endotel- og koagulasjonsaktivering (Switzer mfl. 2006). Det er derfor logisk å tenke seg at inhalasjoner med NO kan ha terapeutisk effekt ved sigdcellekriser, kanskje først og fremst ACS. Det er publisert noen få kasuistiske studier der NO er prøvd terapeutisk ved ACS (Atz 1997, Sullivan 1999, Chang mfl. 2008) og ved smertefulle kriser (Weiner mfl. 2003) med tilsynelatende god effekt.
En randomisert studie av pasienter med SCD (voksne og barn over 10 år) med vasookklusive kriser som ble behandlet med NO-inhalasjoner eller placebo (75 pasienter i hver gruppe), viste ingen signifikant forskjell på varigheten av smerter, varigheten av sykehusopphold, behov for opioider eller utvikling av ACS (Gladwin mfl. 2011).
En fersk metaanalyse (Aboursheid mfl. 2019) av studier på bruk av inhalert NO ved smertefulle kriser hos SCD-pasienter viste ikke holdepunkter for effekt av NO.
Andre
Andre medikamenter som har vært brukt eller utredes i behandlingen av SCD, er butyrat, decitabin, sildenafil, intravenøst immunglobulin, Nix-0699, statiner og diverse andre (Ataga 2009). Nix-0699 (Niprisan®/Nicosan®, et plantederivert middel) er en del brukt i Nigeria, så pasienter som kommer til Norge derfra, kan ha det med seg. Middelet er nylig evaluert i en Cochrane-oversikt, men bare én studie publisert i 2001 ble inkludert. Det ble funnet en mulig gunstig effekt på smertefulle kriser i løpet av 6 måneders observasjonstid, uten påvirkning av graden av anemi eller risikoen for alvorlige komplikasjoner, og uten vesentlige bivirkninger (Oniyangi og Cohall 2015). En studie på bruk av sildenafil hos voksne pasienter med SCD og tegn på pulmonal hypertensjon ble avbrutt pga. økt frekvens av hospitaliseringer pga. smerter i sildenafilgruppen (Machado et al 2011).
Genterapi/genredigering
Det har i mange år vært gjort omfattende forskning med sikte på å helbrede pasienter med ulike genetiske sykdommer, deriblant β-thalassemi og sigdcellesykdom, ved hjelp av genterapi (High og Roncarolo 2019, Orkin og Bauer 2019). Det er flere alternative fremgangsmåter:
- Det kan introduseres et normalt fungerende β-globingen som tillegg til det opprinnelige genmaterialet i autologe stamceller ved hjelp av en lentivirusvektor (additiv genterapi). De endrede stamcellene infunderes deretter i pasienten etter myeloablativ kjemoterapi.
En spesiell utfordring ved SCD er problemet med å høste et tilstrekkelig antall hematopoietiske stamceller. Bruk av G-CSF til mobilisering av perifere stamceller erkontraindisert pga. risikoen for å utløse en vasookklusiv episode, så man må høste fra benmargen, ofte gjentatte høstinger i narkose for å få tilstrekkelig antall celler. En annen mulighet kan være å mobilisere perifere stamceller med plerixafor (Orkin og Bauer 2019). - Alternativt kan man korrigere den spesifikke genfeilen i β-globingenet ved hjelp av designer-nukleaser (f.eks. sink-finger-nukleaser eller Cas9) (genredigering).
- Et annet alternativ er å stimulere økt HbF-produksjon, enten ved å stimulere γ-globintranskripsjonsfaktorer, eller oppheve hemmingen av HbF-produksjonen, slik at denne vedvarer permanent.
Genterapistudiene er kommet lenger for thalassemi enn for sigdcelleanemi, og foreløpig er genterapi ikke aktuell behandling.
Prenataldiagnostikk og screening
Prenataldiagnostikk er mulig, men erfaringene fra andre land tilsier at kvinner med risiko for å få barn med sigdcelleanemi benytter seg av dette i mindre grad enn kvinner som har risiko for å få barn med thalassemia major.
Det er av avgjørende betydning å stille diagnosen så tidlig som overhodet mulig for å få barna inn i et kontroll- og oppfølgingsprogram straks. Det er viktig å starte profylaktisk penicillinbehandling og pneumokokkvaksinering så tidlig som mulig, og foreldrene må informeres og læres opp. Det er enkelt å stille diagnosen i nyfødtperioden, og mange land har screeningprogrammer for sigdcelleanemi hos nyfødte, også i Europa. Det har vært diskutert hvorvidt screening skal omfatte alle nyfødte eller bare nyfødte av spesielle etniske grupper, men flere har gjort den erfaringen at ved screening av utvalgte grupper er det lett å komme i den situasjonen at man ”mister” noen, siden økende forekomst av ”blandede” parforhold gjør det vanskelig å identifisere sikre risikogrupper (Davies SC mfl. 2000, Henthorn mfl. 2004).
Screening for sigdcelleanemi kan utføres med HPLC eller kapillærelektroforese, begge med god sensitivitet og spesifisitet hos fullbårne, noe lavere hos premature (Hustace mfl. 2011). Sigdcelleanemi er dessverre foreløpig ikke med i det norske programmet for nyfødtscreening, men det arbeides med å få inkludert det så snart som mulig. Overføring til voksenavdeling Det er vist i flere studier at mortaliteten øker bratt i tidlig voksen alder, og det er stilt spørsmål ved om dette skyldes sykdommens naturlige forløp eller endringen i oppfølging (oppsummert i Sheth mfl. 2013). Overføring til behandling og oppfølging i voksenavdeling bør skje gradvis og må forberedes i god tid. Siden pasientantallet foreløpig er relativt lite i Norge, har vi nok ikke klart å innarbeide gode overføringsrutiner, men voksenavdelingene har etter hvert også begynt å få erfaring med denne pasientgruppen. I UK guidelines er det anbefalt å starte overføringsprosessen allerede ved 13–14-årsalder, og det er anbefalt at det i forbindelse med overføringen arrangeres en felles konsultasjon mellom det pediatriske og voksne teamet.
Heterozygoter
Heterozygotene er vanligvis symptomfrie, men de har ofte også nedsatt konsentreringsevne i nyrene, og enkelte har symptomgivende sickling i ekstreme situasjoner, f.eks. ved store fysiske anstrengelser, spesielt i stor høyde, kombinert med dehydrering.
Flyreiser
Det stilles ofte spørsmål om det er nødvendig med spesielle forholdsregler ved flyreiser for pasienter med SCD og for heterozygote bærere. Det finnes lite data på området, men en spørreundersøkelse utført blant 700 pasienter med SCD på Jamaica om deres erfaring under og de første 24 timene etter en flyreise avslørte at kun én pasient hadde erfart skjelettsmerter under flyreiser. Dette var en pasient som var kjent for å ha svært hyppige og langvarige smertefulle kriser (Ware mfl. 1998). Generelt er det viktig å passe på å drikke rikelig under flyreiser i tillegg til å holde seg varm, men erfaringen er at flyturer i trykkabin tåles godt, og at ekstra oksygentilførsel er unødvendig.
Pasientorganisasjon
Det finnes en pasientforening for sigdcelleanemi – Norsk Sigdcelleanemi-Forening, som fokuserer på pasientrettet informasjon og veiledning om sykdommen. Nettadressen er www.sigdcelleanemi.no. 5 De har også opprettet en facebookside.
5 Pasientorganisasjonen NSCAO omtalt i tidligere versjoner av programmet er ikke lenger aktiv
Referanser
- Abboud MR, Atweh GR. Prevention and management of strokes in patients with sickle cell disease. Curr Hematol Rep 2006; 5: 15-22
- Abboud MR mfl. Discontinuing prophylactic transfusions increase the risk of silent brain infarction in children with sickle cell disease: data from STOP II. Blood 2011; 118: 894-898
- Aboursheid T mfl. Inhaled nitric oxide for treating pain crises in people with sickle cell disease. Cochrane Database Syst Rev 2019 Oct 11;10(10):CD011808.
doi: 10.1002/14651858.CD011808.pub2. Online ahead of print. - Adamkiewicz TV mfl. Invasive pneumococcal infections in children with sickle cell disease in the era of penicillin prophylaxis, antibiotic resistance, and 23-valent pneumococcal polysaccharide vaccination. J Pediatr 2003; 143: 438-444
- Adams RJ mfl. Prevention of a first stroke by transfusions in children with sickle cell anemia and abnormal results on transcranial Doppler ultrasonography. N Engl J Med 1998; 339: 5-11
- Adams RJ mfl. The Optimizing Primary Stroke Prevention in Sickle Cell Anemia (STOP 2)
Trial Investigators. Discontinuing prophylactic transfusions used to prevent stroke in sickle cell disease. N Engl J Med 2005; 353: 2769-2778 - Adams RJ mfl. Transcranial Doppler re-screening of subjects who participated in STOP and STOP II. Accepted article. Am J Hematol. 2016; Sep 13. doi: 10.1002/ajh.24551
- Adeyoju AB mfl. Priapism in sickle cell disease; incidence, risk factors and complications – an international multicentre study. BJU Int 2002; 90: 898-902
- AlDallal S. Voxelotor: A ray of hope for Sickle disease. Cureus 2020; 12(2): e7105. DOI 10.7759/cureus.7105
- Alvarez O mfl. Serum cystatin C levels in children with sickle cell disase. Pediatr Nephrol 2006; 21: 533-537
- Amrolia PJ mfl. Therapeutic challenges in childhood sickle cell disease. Part 1: Current and future treatment options. Br J Haematol 2003; 120: 725-736
- Amrolia PJ mfl. Therapeutic challenges in childhood sickle cell disease. Part 2: A problemorientated approach. Br J Haematol 2003; 120: 737-743
- Antoniani C mfl. Induction of fetal hemoglobin synthesis by Crispr/Cas9-mediated disruption of the β-globin locus architecture. Blood 2016; 128(22): abstr. 321
- Arnold SD mfl. Haematopoietic stem cell transplantation for sickle cell disease – current practice and new approaches. Br J Haematol 2016; 174: 515-525
- Ataga, KI. Novel therapies in sickle cell disease. Hematology 2009: 54-61
- Ataga KI mfl. Crizanlizumab for the prevention of pain crises in sickle cell disease. New Engl J Med 2016; DOI:10.1056/NEJMoa1611770
- Atz AM and Wessel DL. Inhaled nitric oxide in sickle cell disease with acute chest syndrome (case reports). Anesthesiology 1997; 87: 988-990
- Aygun B mfl. Chronic transfusion practises for prevention of primary stroke in children with sickle cell anemia and abnormal TCD velocities. Am J Hematol 2011; doi: 10.1002/ajh.23105. [Epub ahead of print]
- Bellet PS mfl. Incentive spirometry to prevent acute pulmonary complications in sickle cell diseases. N Engl J Med 1995; 333: 699-703
- Bernaudin F mfl. Impact of early transcranial Doppler screening and intensive therapy on cerebral vasculopathy outcome in a newborn sickle cell anemia cohort. Blood 2011; 117: 1130-1140
- Bernaudin F mfl. Chronic and acute anemia and extracranial internal carotid stenosis are risk factors for silent cerebral infarcts in sickle cell anemia. Blood 2015; 125: 1653-1661
- Black S mfl. Postlicensure surveillance for pneumococcal invasive disease after use of heptavalent pneumococcal conjugate vaccine in Northern California Kaiser Permanente.
Pediatr Infect Dis J 2004; 23: 485-489 - Blake K, Lima J. Asthma in sickle cell disease: implications for treatment. Anemia 2011; 2011:740235
- Blaisdell CJ, Goodman S, Clark K, Casella JF, Loughlin GM. Pulse oximetry is a poor predictor of hypoxemia in stable children with sickle cell disease. Arch Paediatr Adolesc Med 2000; 154: 900-903
- Broderick GA. Priapism and sickle cell anemia: diagnosis and nonsurgical therapy. J Sex Med 2012; 9: 88-103
- Brousse V mfl. Acute splenic sequestration crisis in sickle cell disease: cohort study of 190 paediatric patients. Br J Haematol 2012; 156: 643-648
- Buchanan GR, Yawn BP (co-chairs). Evidence-based management of sickle cell disease.
Expert panel report, 2014. US Department of Health and Human Services National Institutes of Health. National Heart, Lung and Blood Institute - Burnett AL mfl. Randomized controlled trial of sildenafil for preventing recurrent ischemic priapism in sickle cell disease. Am J Med 2014; 127: 664-448.
doi:10.1016/j.amjmed.2014.03.01 - Chang W-L, Corate LM, Sinclair JM, vd Heyde HC. Continuous inhaled nitric oxide therapy in a case of sickle cell disease with multiorgan involvement. J Investig Med 2008; 56: 1023-1027
- Charache S mfl. Effect of hydroxyurea on the frequency of painful crises in sickle cell anemia. N Eng J Med 1995; 332: 1317-1322
- Chaturvedi S mfl. Rapidly progressive acute chest syndrome in individuals with sickle cell anemia. Accepted article, Am J Hematol 2016; doi: 10.1002/ajh.24539
- Cieri-Hutcherson NE mfl. Systematic review of L-glutamine for prevention of vaso-occlusive pain crisis in patients with sickle cell disease. Pharmacotherapy 2019; 39: 1095-1104. doi: 10.1002/phar.2329
- Chinegwundoh FI mfl. Treatments for priapism in boys and men with sickle cell disease.
Cochrane Database Syst Rev. 2017 Sep; 2017(9): CD004198 - Crabtree EA mfl. Improving care for children with sickle cell disease/acute chest syndrome.
Pediatrics 2011; 127: e480-e488 - Davies EG mfl. Pneumococcal vaccines for sickle cell disease. Cochrane database of systematic reviews 2004; 1
- Davies P, Robertson S, Hegde S, Greenwood R, Massey E, Davis P. Calculating the required transfusion volume in children. Transfusion 2007; 47: 212-216
- Davies SC and Gilmore A. The role of hydroxyurea in the management of sickle cell disease.
Blood Rev 2003; 17: 99-109 - Davies SC and Olatunji PO. Blood transfusion in sickle cell disease. Vox Sanguinis 1995; 68: 145-151
- Davies SC and Roberts-Harewood M. Blood transfusion in sickle cell disease. Blood Rev 1997; 11: 57-71
- Davies SC mfl. Screening for sickle cell disease and thalassaemia: a systematic review with supplementary research. Health Technol Assess 2000; 4(3)
- Davies SC mfl. Screening for sickle cell disease and thalassaemia: a systematic review with supplementary research. Health Technol Assess 2000; 4(3)
- DeBaun MR. Hydroxyurea therapy contributes to infertility in adult men with sickle cell disease: a review. Expert Rev Hematol 2014; 7: 767-773
- Dick MC. Standards for the management of sickle cell disease in children. Arch Dis Child Educ Pract Ed 2008; 93: 169-176
- Dobson SR mfl. Moyamoya syndrome in childhood sickle cell disease: a predictive factor for recurrent cerebrovascular events. Blood 2002; 99: 3144-3150
- Downes SM, Hambleton IR, Chuang EL, Lois N, Serjeant GR, Bird AC. Incidence and natural history of proliferative sickle cell retinopathy: observations from a cohort study.
Ophthalmology 2005; 112(11): 1869-75 - Fein DM mfl. Intranasal fentanyl for initial treatment of vaso-occlusive crisis in sickle cell disease. Pediatr Blood Cancer 2016; DOI: 10.1002/pbc.26332
- Ferster A mfl. Five years experience with hydroxyurea in children and young adults with sickle cell disease. Blood 2001; 97: 3628-3632
- Field JJ, Vichinsky EP. Overview of the clinical manifestatons of sickle cell disease.
https://www.uptodate.com/contents/overview-of-the-clinical-manifestations-of-sickle-cell-disease?search=sickle cell disease, hyperhemolytic crisis§ionRank=1&usage_type=default&anchor=H3542457390&source=machineLearning&selectedTitle=1~150&display_rank=1#H3542457390 - Fitzgerald RK, Johnson A. Pulse oximetry in sickle cell anemia. Crit Care Med 2001; 29: 1803-1806
- Fitzhugh CD mfl. "Hematopoietic stem cell transplantation for patients with sickle cell disease: progress and future directions". Hematol Oncol Clin North Am 2014; 28: 1171-1185
- Fullerton HJ mfl. Declining stroke rates in Californian children with sickle cell disease. Blood 2004; 104: 336-339
- Gladwin MT mfl. Nitric oxide for inhalation in the acute treatment of sickle cell pain crisis. A randomized controlled trial. JAMA 2011; 305: 893-902
- Halasa NB mfl. Incidence of invasive pneumococcal disease among individuals with sickle cell disease before and after the introduction of the pneumococcal conjugate vaccine. Clin Infect Dis 2007; 44: 1428-1433
- Han J mfl. Adverse reactions to pneumococcal vaccine in pediatric and adolescent patients with sickle cell disease. Pharmacotherapy 2015; 35: 696-700
- Hankins J mfl. Chronic transfusion therapy for children with sickle cell disease and recurrent acute chest syndrome. J Pediatr Hematol Oncol 2005; 27: 158-161
- Hankins JS mfl. Long-term hydroxyurea therapy for infants with sickle cell anemia: the
HUSOFT extension study. Blood 2005; 106: 2269-2275 - Hankins JS mfl. From infancy to adolescence: over a decade of continuous hydroxyurea therapy in sickle cell anemia. ASPHO Annual Meeting Abstract. Pediatr Blood Cancer 2010; 54: 790
- Hankins JS mfl. From infancy to adolescence: fifteen years of continuous treatment with hydroxyurea in sickle cell anemia. Medicine 2014; 93(28):e215
- Heeney M, Mahoney DH. The acute chest syndrome in children and adolescents with sickle cell disease. https://www.uptodate.com/contents/the-acute-chest-syndrome-in-children-and-adolescents-with-sickle-cell-disease?search=sickle cell disease children&topicRef=7121&source=see_link
Aksessert 06.05.2020 - Heeney MM, Ware RE. Hydroxyurea for children with sickle cell disease. Hematol Oncol
Clin N Am 2010; 24: 199-214 - Heeney MM, Wharton MR, Howard TA, Johnson CA, Ware RE. Chemical and functional analysis of hydryoxyurea oral solutions. J Pediatr Hematol Oncol 2004; 26: 179-184
- Helton KJ mfl. Magnetic resonance imaging/angiography and transcranial Doppler velocities in sickle cell anemia: results from the SWiTCH trial. Blood 2014; 124: 891-898
- Hematology/Oncology Clinics of North America 2005; 19(5). Temanummer om sigdcelleanemi
- Henthorn JS mfl. Neonatal screening for sickle cell disorders. Br J Haematol 2004; 124: 259-263
- High KA, Roncarolo MG. Gene therapy. New Engl J Medicine 2019; 381: 455-464
- Hogan AM mfl. Intellectual decline in children with moyamoya and sickle cell anaemia. Dev Med Child Neurol 2005; 47: 824-829
- Hoppe C. Defining stroke risk in children with sickle cell anaemia. Br J Haematol 2004; 128: 751-766
- Howard J. Sickle cell disease: when and how to transfuse. Hematology 2016: 625-631
- Howard J mfl. A phase 1/2 ascending dose study and open-label extension study of voxelotor in patients with sickle cell disease. Blood 2019; 133: 1865-1875
- Hustace T mfl. Increased prevalence of false positive hemoglobinopathy newborn screening in premature infants. Pediatr Blood Cancer 2011; 57: 1039-1043
- Hutchaleelaha A mfl. Pharmacokinetics and pharmacodynamics of voxelotor (GBT440) in healthy adults and patients with sickle cell disease. Br J Clin Pharmacol. 2019; 85: 1290–1302
- Johnson CS. Arterial blood pressure and hyperviscosity in sickle cell disease. Hematol/ Oncol
Clin N Am 2005; 19: 827-837 - Johnson CS. The acute chest syndrome. Hematol/Oncol Clin N Am 2005; 19: 857-879
- Kassim AA, DeBaun M. The case for and against initiating either hydroxyurea therapy, blood transfusion therapy or hematopoietic stem cell transplant in asymptomatic children with sickle cell disease. Expert Opin Pharmacother 2014; 15: 325-336
- Kato GJ mfl. Deconstructing sickle cell disease: Reappraisal of the role of hemolysis in the development of clinical subtypes. Blood Rev 2007; 21: 37-47
- Kinney TR mfl. Long-term management of splenic sequestration in children with sickle cell disease. J Pediatr 1990; 117: 194-199
- Kinney TR mfl. Safety of hydroxyurea in children with sickle cell anemia: Results of the HUG-KIDS study, a phase I/II trial. Blood 1999; 94: 1550-1554
- Kutlar A mfl. Effect of crizanlizumab on pain crises in subgroups of patients with sickle cell disease: A SUSTAIN study analysis. Am J Hematol 2019; 94: 55-61
- Lefèvre N, Dufour D. Gulbis B, Lè P-Q, Heijmans C, Ferster A. Use of hydroxyurea in prevention of stroke in children with sickle cell disease. Blood; 2008: 111: 963-964
- Lilleyman J, Hann I, Blanchette V (eds). Pediatric Hematology, 2nd edition 1999, Churchill Livingstone
- Lobo CLdC mfl. The effect of hydroxycarbamide therapy on survival of children with sickle cell disease. Br J Haematol 2013; 161: 852-860
- Machado RF mfl. Hospitalization for pain in patients with sickle cell disease treated with sildenafil for elevated TRV and low exercise capacity. Blood 2011; 118: 855-864
- Maitre B mfl. Inhaled nitric oxide for acute chest syndrome in adult sickle cell patients: a randomized controlled study. Intensive Care Med 2015; 41: 2121-2129
- Marouf R mfl. Comparison of renal function markers in Kuwaiti patients with sickle cell disease. J Clin Pathol 2006; 59: 345-351
- Matevosyan K, Anderson C, Sarode R. Isovolemic hemodilution-red cell exchange for prevention of cerebrovascular accident in sickle cell anemia: the standard operating porcedure. J Clin Apheresis 2012: doi: 10.1002/jca.21203
- McGann PT, Ware RE. Hydroxyurea for sickle cell anemia: what have we learned and what questions still remain? Curr Opin Hematol 2011; 18: 158-165
- Miller ML mfl. Cephalosporin-resistant pneumococci and sickle cell disease. Emerg Infect Dis 2005; 11: 1192-1196
- Miller ST. How I treat acute chest syndrome in children with sickle cell disease. Blood 2011; 117: 5297-5305
- de Montalambert M, Brousse V, Elie C, Bernaudin F, Shi J, Landais P. Long-term hydroxyurea treatment in children with sickle cell disease: tolerance and clinical outcomes.
Haematologica 2006; 91: 125-128 - Morris CR. Asthma management: reinventing the wheel in sickle cell disease. Am J Hematol 2009; 84: 234-241
- Musallam KM mfl.. Clinical experience with fetal hemoglobin induction therapy in patients with β-thalassemia. Blood 2013; 121: 2199-2212
- Nathan DG, Orkin SH (eds). Nathan and Oski’s Hematology of Infancy and Childhood, 6th edition 2003
- National Institutes of Health: The management of sickle cell disease. 4th edition 2002
- Newaskar M, Hardy KA, Morris CR. Asthma in sickle cell disease. ScientificWorldJournal 2011; 11: 1138-1152
- NHS. Sickle cell disease in childhood. Standards and guidelines for clinical care. Second edition October 2010 (1332-SC-Clinical-Standards-WEB.pdf)
- Nickel RS mfl. The ethics of a proposed study of hematopoietic stem cell transplant for children with "less severe" sickle cell disease. Blood 2014; 124: 861-866
- Obaro SK, Inusa B, Telfer P. Hydroxycarbamide use in young children with sickle cell anaemia. Lancet 2011; 378: 1777
- O’Brian KL mfl. Safety and immunogenicity of heptavalent pneumococcal vaccine conjugated to CRM197 among infants with sickle cell disease. Pediatrics 2000; 106: 965-972
- Okpala IE. New therapies for sickle cell disease. Hematol/Oncol Clin N Am 2005; 19: 975-987
- Olivieri NF mfl. Hydroxyurea in children with sickle cell disease: Impact on splenic function and compliance with therapy. J Pediatr Hematol/Oncol 1998; 20: 26-31
- Olujohungbe AB mfl. A prospective diary study of stuttering priapism in adolescents and young men with sickle cell anemia: report of an international randomized control trial – the priapism in sickle cell study. J Androl 2011; 32: 375-382
- Oniyangi O, Cohall DH. Phytomedicines (medicines derived from plants) for sickle cell disease (review). Cochrane Database Syst Rev 2015 Apr 6;(4):CD004448. doi: 10.1002/14651858.CD004448.pub5
- Orkin SH, Bauer DE. Emerging genetic therapy for sickle cell disease. Annu Rev Med 2019; 70: 257-271
- Padman R, Henry M. The use of bilevel positive airway pressure for the treatment of acute chest syndrome of sickle cell disease. Delaware Med J 2004; 76: 199-203
- Platt OS. The acute chest syndrome in sickle cell disease. N Engl J Med 2000; 342: 1904-1907
- Quinn CT mfl. Prognostic significance of early vaso-occlusive complications in children with sickle cell anemia. Blood 2007; 109: 40-45
- Robinson TM, Fuchs EJ. Allogeneic stem cell transplantation for sickle cell disease. Curr Opin Hematol 2016; 23: 524-529
- Rodgers GP (ed). Baillère’s Clinical Haematology 1998; 11(1). Temanummer om sigdcelleanemi og thalassemi
- Rosenberg JB, Hutcheson KA. Pediatric sickle cell retinopathy: Correlation with clinical factors. J AAPOS 2011; 15: 49-53.
- Sandbu S. Vaksinasjonsboka. Veiledning om vaksinasjon for helsepersonell 2006.
Folkehelseinstituttet - Scott JP mfl. Hydroxyurea therapy in children severely affected with sickle cell disease. J
Pediatr 1996; 128: 820-828 - Serjeant G. Blood transfusion in sickle cell disease: a cautionary tale. Lancet 2003; 361: 1659-1660
- Sheth S mfl. Sickle cell disease: time for a closer look at treatment options? Br J Haematol 2013; 162: 455-464
- Smith-Whitley K. Reproductive issues in sickle cell disease. Blood 2014; 124: 3538-3543
- Steinberg MH. Predicting clinical severity in sickle cell anaemia. Br J Haematol 2005; 129: 465-481
- Steinberg MH mfl. Effect of hydroxyurea on mortality and morbidity in adult sickle cell anemia. Risks and benefits up to 9 years of treatment. JAMA 2003; 289: 1645-1651
- Steinberg MH mfl. The risks and benefits of long-tern use of hydroxyurea in sickle cell anemia: A 17.5 year follow-up. Am J Hematol 2010; 85: 403-408
- Stuart MJ and Setty BNY. Sickle cell acute chest syndrome: pathogenesis and rationale for treatment. Blood 1999; 94: 1555-1560
- Sullivan KJ mfl. Nitric oxide successfully used to treat acute chest syndrome of sickle cell disease in a young adolescent (case report). Crit Care Med 1999; 27: 2563-2568
- Swerdlow PS. Red cell exchange in sickle cell disease. Hematology 2006: 48-53
- Switzer JA mfl. Pathophysiology and treatment of stroke in sickle-cell disease: present and future. Lancet Neurol 2006; 5: 501-512
- Sylvester KP mfl. Temporal relationship of asthma to acute chest syndrome in sickle cell disease. Pediatr Pulmonol 2007; 42: 103-106
- Takahashi Y mfl. Hydroxycarbamide use in young children with sickle cell anaemia. Lancet 2011; 378: 1777
- Talano J-AM mfl. Delayed hemolytic transfusion reaction/hyperhemolysis syndrome in children with sickle cell disease. Pediatrics 2003; 111: e661-e665
- Tomer A mfl. Reduction of pain episodes and prothrombotic activity in sickle cell disease by dietary n-3 fatty acids. Thromb Haemost 2001; 85: 966-974
- Ullrich H mfl. Erythrocytapheresis: do not forget a useful therapy! Transfus Med Hemother 2008; 35: 24-30
- Uzun B, Kekec Z, Gurkan E. Efficacy of tramadol vs meperidine in vasoocclusive sickle cell crisis. Am J Emerg Med 2010; 28: 445-449
- Vichinsky EP mfl. Causes and outcomes of the acute chest syndrome in sickle cell disease. N
Engl J Med 2000; 342: 1855-1865 - Vichinsky E mfl. A phase 3 randomized trial of voxelotor in sickle cell disease. N Engl J Med 2019; 381: 509-519
- Vichinsky EP. Disease-modifying therapies for prevention of vaso-occlusive pain in sickle cell disease. https://www.uptodate.com/contents/disease-modifying-therapies-for-prevention-of-vaso-occlusive-pain-in-sickle-cell-disease?search=sickle cell disease, disease-modifying therapies&source=search_result&selectedTitle=2~150&usage_type=default&display_rank=2. Aksessert 14/4-2020
- Wang WC mfl. Hydroxycarbamide in very young children with sickle-cell anaemia: a multicentre, randomised, controlled trial (BABY HUG). Lancet 2011; 377: 1663-1672
- Wanko SO and Telen MJ. Transfusion management in sickle cell disease. Hematol/Oncol
Clin N Am 2005; 19: 803-826 - Ware M, Tyghter D, Staniforth S, Serjeant G. Airline travel in sickle-cell disease. Lancet 1998; 352: 652
- Ware RE. How I treat: How I use hydroxyurea to treat young patients with sickle cell anemia.
Blood 2010; 115: 5300-5311 - Ware RE mfl. Hydroxyurea as an alternative to blood transfusions for the prevention of recurrent stroke in children with sickle cell disease. Blood 1999; 94: 3022-3026
- Ware RE mfl. Prevention of secondary stroke and resolution of transfusional iron overload in children with sickle cell anemia using hydroxyurea and phlebotomy. J Pediatr 2004; 145: 346-
- Ware RE, mfl. Stroke with transfusions changing to hydroxyurea (SWiTCH). Blood 2012; first edition paper, doi 10.1182/blood-2011-11-392340
- Ware RE mfl. Hydroxycarbamide versus chronic transfusion for maintenance of transcranial doppler flow velocities in children with sickle cell anaemia – TCD With Transfusions Changing to Hydroxyurea (TWiTCH): a multicentre, open-label, phase 3, non-inferiority trial.
Lancet 2016; 387: 661-670 - Weiner DL mfl. Preliminary assessment of inhaled nitric oxide for acute vaso-occlusive crisis in pediatric patients with sickle cell disease. JAMA 2003; 289: 1136-1142
- Wills KE mfl. Transition planning for youth with sickle cell disease: embedding neuropsychological assessment into comprehensive care. Pediatrics 2010; 126: S151-S159
- Wong W-Y and Powars DR. Overt and incomplete (silent) cerebral infarction in sickle cell anemia: Diagnosis and management. Hematol Oncol Clin N Am 2005; 19: 839-855
- Wright JG mfl. Postsplenectomy course in homozygous sickle cell disease. J Pediatr 1999; 134: 304-309
- Yanni E mfl. Trends in pediatric sickle cell disease-related mortality in the United States, 1983-2002. J Pediatr 2009; 154: 541-545.
- Zimmerman SA mfl. Sustained long-term hematologic efficacy of hydroxyurea at maximum tolerated dose in children with sickle cell disease. Blood 2004; 103: 2039-2045
- Zimmerman SA, Schultz WH, Burgett S, Mortier NA, Ware RE. Hydroxyurea therapy lowers transcranial Doppler flow velocities in children with sickle cell anemia. Blood 2007; 110: 1043-1047










