Generell veileder i pediatri
5. Mage, tarm, lever og ernæring
5.16 Eosinofil øsofagitt
Sist faglig oppdatert: 01.01.2017
Anders Batman Mjelle og Erling Tjora
Bakgrunn
Eosinofil øsofagitt (EoE) er en kronisk immunmediert/antigenmediert spiserørssykdom assosiert med spiserørsdysfunksjon og eosinofil-dominert inflammasjon.
Forekomst
Insidens ser ut til å ligge mellom 1 og 5 per 10.000 i barnebefolkningen, men tallene varierer mye. Tilstanden debuterer ofte fra skolealder og inn i voksen alder. Det er vanlig med atopisk lidelse hos pasienten eller i familien, enten astma, eksem, rhinitt eller anafylaktisk matallergi. Tilstanden er vanligst hos gutter (3:1 i forhold til jenter).
Patogenese
Patogenesen er kompleks og ikke helt kartlagt. Den har imidlertid tydelige sammenheng med matallergener, atopisk og allergisk sykdom, men betydningen av inhalasjonsallergener er mer kontroversiell. Det er beskrevet overhyppighet av utslag på allergitest av luftveisallergener, både spesifikt IgE og prikktester. Det er imidlertid usikkert om inhalasjonsallergener påvirker utviklingen av EoE. En tror at den dominerende mekanismen for matallergi ved EoE ikke er IgE-mediert.
Symptomer og funn
De minste barna har oftest symptomer som spisevegring, gulping og oppkast som kan føre til faltering growth, etter hvert oppkast og magesmerter eller retrosternale smerter. Hos ungdom og voksne er det vanligste dysfagi og fastsittende mat i spiserøret. Blant voksne møter 60 % av pasientene helsevesenet for første gang på grunn av mat som setter seg fast i spiserøret, og 20 % av voksne pasienter har samtidig halsbrann. Det er ikke uvanlig med forsinkelse på flere måneder, av og til år, fra symptomer begynner å utvikle seg, til diagnosen stilles. Sykdommen utvikles gradvis, i tillegg til at mange vil utvikle mottrekk mot symptomene, ved f.eks. å tygge lenge, bruke lang tid på måltider, svelge mat med mer vann og unngå enkelte matvarer som har lettere for å sette seg fast.
Diagnostikk og utredning
Blodprøvesvar er uspesifikke. Ofte ses økt antall eosinofile granulocytter i blod, i tillegg ofte utslag for spesifikt IgE for enkelte matvarer (uten at dette nødvendigvis er matvaren som gir EoE hos pasienten).
Endoskopisk undersøkelse er nødvendig for å stille diagnosen. Typisk sees horisontal ringdannelse («trakealisering», konsentriske ringer som likner de i trakea) og fortykket, noen ganger blek, mucosa med langsgående furer. En kan også se hvitlige plakk i slimhinnen som representerer eosinofile mikroabscesser. Mer sjelden kan en påvise korte strikturer eller et lengre område med smalkalibret spiserør. Akronymet FØRES beskriver de vanligste funn: furer, ødem, ringer, eksudater og striktur. Normale endoskopiske funn utelukker imidlertid ikke EoE, og det skal uansett tas 2-4 vevsprøver både fra distale og proksimale del av spiserøret, totalt minst 6 biopsier ved klinisk mistanke om EoE. En bør ved biopsitaking ha spesielt fokus på området med endoskopiske funn, og en bør ha separate glass for distale og proksimale biopsier.
Histologisk finner man ved EoE økt antall eosinofile granulocytter både proksimalt og distalt i spiserøret, mens eosinofili hovedsakelig distalt kan være et funn ved blant annet gastroøsofageal refluks. De histologiske funn er eosinofili i mucosa, som oftest langs hele forløpet av spiserøret, basallagshyperplasi, fibrose i lamina propria og av og til eosinofile mikroabscesser. Diagnosen EoE krever ≥15 eosinofile/synsfelt ved 400 ganger forstørrelse i lysmikroskopet (≥15 eos/hpf). Vevsprøver består imidlertid oftest av epitel, og undersøkelsen kan dermed undervurdere dypereliggende sykdomsaktivitet.
Allergitesting med spesifikt IgE og prikktesting for de vanligste matvare- og inhalasjonsallergener hører med i utredningen, men diagnostisk verdi er generelt lav. Negativ prediktiv verdi er noe høyere enn positiv prediktiv verdi, med unntak av melkeprotein, der også negativ prediktiv verdi er svært lav.
Differensialdiagnoser
Gastroøsofageal reflukssykdom er viktigste differensialdiagnose, men også andre sykdommer er assosiert med øsofageal eosinofili, som infeksiøs øsofagitt, akalasi, cøliaki, Crohns sykdom, bindevevssykdommer, graft versus host disease (GVHD), medikamenthypersensitivitet og hypereosinofile syndromer.
En må også huske at det kan foreligge både reflukssykdom og EoE samtidig – sykdommene er tett forbundet, og begge sykdommene har flere egenskaper som øker sjansen for utvikling av også den andre sykdommen. At 25-50 % av alle med EoE blir bedre av syredempende, gjør det ikke enklere å skille tilstandene.
Behandling og oppfølging
Behandling
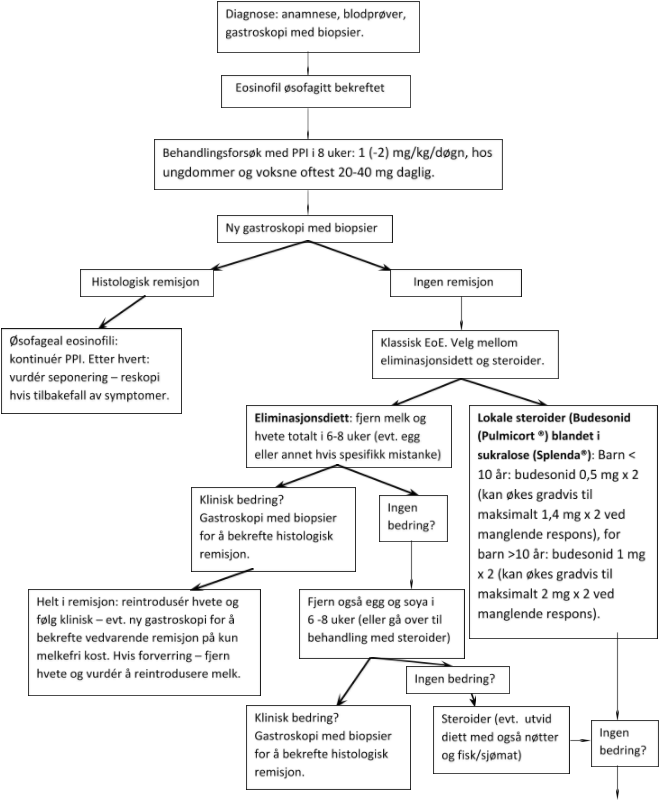
Ved etablert diagnose, gjøres først et forsøk med en protonpumpehemmer (PPI) (omeprazol, lanzoprazol, pantoprazol eller esomeprazol). Vanlig dosering er 1 (-2) mg/kg/døgn, hos ungdommer og voksne oftest 20-40 mg daglig. Utprøvingen bør vare 8 uker (kan stoppes tidligere hvis betydelig symptomer uten bedring på PPI, særlig hos mindre barn), og hvis mulig bør en gastroskopere pasienten på nytt mot slutten av perioden. Er det da fortsatt ≥15 eos/hpf, er diagnosen EoE styrket. Hvis det så er blitt under 15 eos/hpf, kan det være PPI-responsiv eosinofil øsofagitt/øsofageal eosinofili, gastroøsofageal reflukssykdom eller annen sykdom.
Ved EoE, hvor PPI ikke har noen effekt, har en i praksis to valg: diett eller steroider. Valget må diskuteres i hvert tilfelle. Uansett valg, anbefales 4-12 uker med behandling før ny gastroskopi med biopsier.
Eliminasjonsdiett
Noen vil ha effekt av å fjerne en bestemt matvare, mens noen trenger å fjerne mange. I en studie hadde 1/3 barn bedring ved fjerning av én enkelt matvare, mens 25 % måtte fjerne minst 4 matvarer. Vanligste fødemiddelallergen er melk, deretter hvete, soya og egg. Allergitesting vil ikke sikkert kunne si hvem som har effekt av eliminering og hvem som ikke har effekt. Positiv allergitest vil også kunne være uttrykk for en reell allergi, uten at denne har noen utløsende rolle ved EoE hos pasienten. Eliminasjonsdiett kan være krevende for pasient og foresatte, og krever nøye oppfølging hos ernæringsfysiolog.
Det er tre måter å angripe diettbehandlingen:
Aminosyrebasert ernæring (null matallergener), målrettet eliminasjonsdiett (som fjerner kun mistenkte allergener) og empirisk eliminasjonsdiett (hvor en fjerner de vanligste allergener: melk, soya, egg, hvete, peanøtter og fisk/sjømat). Aminosyrebasert ernæring er antakelig mest effektive behandlingsform, men vil være vanskelig å akseptere hos større barn og ungdommer, da det vil oppleves som et svært restriktivt kosthold. Det bør derfor forbeholdes barn med multiple matallergier, dårlig tilvekst og alvorlig sykdom, hvor streng diett med mange restriksjoner er vanskelig å gjennomføre.
Målrettet eliminasjonsdiett innebærer fjerning av matvarer som er mistenkte enten på basis av anamnese eller allergitester. I tillegg anbefales det at en uansett fjerner melk fra kosten, ettersom dette er det vanligste allergenet. Metoden vanskeliggjøres av at allergitesting medfører stor risiko for både falsk positive og falsk negative, men er et godt alternativ ved sterk klinisk mistanke om spesifikke matvareallergier. Etter 8-12 uker gjennomføres ny gastroskopi med biopsier, og ved histologisk remisjon reintroduseres én og én matvare.
Empirisk eliminasjonsdiett («6 food elimination diet») er en praktisk form for eliminasjonsdiett, med fjerning av melk, soya, egg, hvete, peanøtter og fisk/sjømat i 8-12 uker, før en reskoperer og biopserer på nytt. Ved histologisk remisjon, starter en reintroduksjon av én og én matvare, til en finner den eller de matvarene som trigger sykdommen. En starter med empirisk minst sannsynlig årsak og arbeider seg opp til vanligste årsak – rekkefølgen er da først gjeninnføring av fisk/sjømat, deretter nøtter, soya, egg, hvete og til sist melk. Et alternativ er at en begynner med de 1-2 empirisk vanligste årsakene og deretter utvider dietten ved manglende effekt.
Ved eliminasjonsdiett hvor en ikke oppnår histologisk remisjon, må en vurdere:
- følger pasienten dietten?
- er det andre matvarer en heller bør eliminere?
- skal medikamentell behandling startes?
Medikamentell behandling
Steroider som svelges (og dermed virker lokalt) er vist å ha svært god effekt ved EoE. Vanligst er budesonid (Pulmicort) inhalasjonsvæske. Flutikason kan brukes, men inhalasjonsaerosol (som sprayes i munn og så svelges) er mindre effektivt. Etter avsluttet behandling, vil mange få residiv av symptomer.
Førstevalg for barn < 10 år: budesonid 0,5 mg x 2 (kan økes gradvis til maksimalt 1,4 mg x 2 ved manglende respons), for barn >10 år: budesonid 1 mg x 2 (kan økes gradvis til maksimalt 2 mg x 2 ved manglende respons). Inhalasjonsvæsken bør blandes med et vehikkel for å øke viskositeten. Søtningsstoffet sukralose (Splenda®) 10 g i 1 mL inhalasjonsvæske har vært brukt, men også bl.a. Neocate Nutra har vist seg effektivt.
Flutikason til svelging doseres 100 – 440 µg 2-4 ganger daglig hos barn, 440 – 880 µg 2 ganger daglig hos ungdom og voksne.
Det anbefales daglig behandling i 4 – 12 uker, enten alene eller i kombinasjon med eliminasjonsdiett. Behandlingseffekt bør vurderes ved gastroskopi med biopsitaking. Ved histologisk remisjon, kan en gå ned i dosering og etter hvert slutte med medisiner. Ved nye symptomer etter avsluttet behandling, anbefales ny gastroskopi med biopsitaking.
Systemiske steroider:
Brukes kun i alvorlige tilfeller hvor rask remisjon kreves, som ved alvorlig dysfagi, vekttap, øsofagusstrikturer. Dosering prednisolon 1-2 mg/kg/døgn (maksimalt 40 mg) p.o. i 2-4 uker med gradvis nedtrapping. Alternativt metylprednisolon i.v. hvis en ikke kan gi medisin per os.
Blokking/dilatasjon av spiserør
Ved signifikant øsofagusstriktur, kan blokking av spiserøret være nødvendig. Det er ikke et alternativ til annen behandling, ettersom det ikke påvirker inflammasjonsprosessen, men noe som kan gi symptombedring når sykdommen til tross for adekvat behandling har ført til betydelig forsnevring av spiserøret. Prosedyren er forbundet med lav komplikasjonsrate.
Oppfølging
EoE regnes som en kronisk, tilbakevendende sykdom, og vil vanligvis kreve langvarig oppfølging hos barnelege, eventuelt med hjelp av klinisk ernæringsfysiolog. De fleste vil ha behov for varig eller intermitterende behandling, mens enkelte vil være asymptomatiske uten behandling – det vil da være mulig å avslutte kontrollene og be om rehenvisning ved nye symptomer.
Selv om ingen studier har sett på langtidskonsekvenser av persisterende øsofageal eosinofili hos asymptomatiske, kan en ikke utelukke utvikling av fibrose og redusert spiserørskaliber på sikt.
Behandlingsalgoritme:
Referanser:
- Lucendo et al. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J. 2017 Apr; 5(3): 335-358.
- Papadopoulou, A. et al. Management guidelines of eosinophilic esophagitis in childhood. JPGN 2014;58:107-118. 3. Furuta, GT., Katzka, DA. Eosinophilic esophagitis. N Engl J Med 2015;373:1640-8.
- Hirano, I. 2015 David Y. Graham Lecture: the first two decades of eosinophilic esophagitis – from acid reflux to food allergy. Am J Gastroenterol 2016; 111:770-776.
- Holme, Ø., Tjora, E., Aabakken, L. Eosinofil øsofagitt. Tidsskr Nor Legeforen 2011; 131:2470-4.










