Generell veileder i pediatri
3. Infeksjoner, vaksiner og undersøkelse av adoptivbarn
3.5 Tuberkulose
Sist faglig oppdatert: 30.11.2025
Per Kristian Knudsen, John Espen Gjøen, Henrik Døllner, Claus Klingenberg og Astrid Rojahn
Tuberkuloseveilederen fra Folkehelseinstituttet (FHI) har blitt erstattet av et litt utvidet kapittel om tuberkulose i Smittevernhåndboka Tuberkulose - FHI. Dette kapittelet er mye mindre omfattende enn den tidligere Tuberkuloseveilederen som inntil videre fortsatt vil være tilgjengelig, men ikke bli videre oppdatert Tuberkuloseveilederen - FHI.
Aktuelle diagnosekoder ICD-10:
A15–A19: Ulike former for aktiv tuberkulose
Z22.7: Latent tuberkulose
Forkortelser brukt i dette avsnittet:
TB: Tuberkulose
PTB: Pulmonal tuberkulose
EPTB: Ekstrapulmonal tuberkulose
IGRA: Interferon-Gamma Release Assay
INH: Isoniazid
RIF: Rifampicin
Bakgrunn
- Human TB skyldes smitte med bakterier som inngår i Mycobacterium tuberculosis-komplekset (vanligvis M. tuberculosis, M. bovis, M. africanum) fra en person med PTB som hoster.
- Nesten alle tilfeller av TB i Norge er forårsaket av M. tuberculosis. I praksis er det nesten bare familiemedlemmer og andre som over tid er i nærkontakt med en smitteførende (voksen) pasient som blir smittet (1).
- De aller fleste som diagnostiseres med TB i Norge er født i Ukraina, Afrika eller Asia, eller er smittet av familiemedlemmer fra disse regionene.
Fra 2013–19 har antallet TB-pasienter årlig i Norge gått gradvis ned fra nesten 400 til 165, hvorav i snitt 14 % har forekommet hos barn og unge < 20 år (MSIS-data). I denne aldersgruppen fant man i samme periode isolert PTB hos 52 % av pasientene, isolert EPTB hos 30 %, mens 17 % hadde begge typer. Barn med TB har lavere bakteriemengde i kroppen, utvikler sjeldnere kavernøs sykdom, og smitter sjelden andre.
Siden 2022 har det vært en økning av TB-tilfeller diagnostisert hos flyktninger fra Ukraina.
Ved håndtering og oppfølging av barn som har blitt eksponert for TB, skilles det mellom følgende tre kliniske situasjoner:
- Eksponert for TB, men ikke smittet: Ingen sykdomstegn og negativ IGRA-test.
- Smittet med TB, men ikke syk = Latent tuberkulose: Ingen sykdomstegn, positiv IGRA-test, ikke tegn til aktiv sykdom på rtg. thorax (men forkalkninger og fibrotiske forandringer kan sees etter gjennomgått infeksjon).
- Aktiv TB sykdom: Kliniske symptomer og som regel rtg. thorax-forandringer (eller ekstrapulmonale organfunn) forenlig med aktiv sykdom, som oftest positiv IGRA-test. Vekst av M. tuberculosis-komplekset i representativt materiale bekrefter diagnosen, men er ikke obligat for å stille diagnosen.
Symptomer og funn
- Ved PTB hos barn er de vanligste symptomer langvarig hoste (> 2 uker) og vekttap, ev. slapphet, anoreksi, feber og nattesvette. Spesielt hos små barn kan symptombildet variere med uspesifikke allmennsymptomer og manglende trivsel/vekst (2,3).
- Ved EPTB er det spesifikke organsymptomer. Hyppigst forekommer cervical lymfeknute-TB (rundt 2/3 av all EPTB). Andre former for EPTB er pleuritt, osteomyelitt, artritt, meningitt og gastrointestinal-/urogenitalaffeksjon.
- TB i sentralnervesystemet kan manifestere seg med meningitt og kramper, men CNS-symptomer kan mangle, og diagnosen kan være vanskelig å stille, spesielt hos små barn.
- Systemiske symptomer og tegn som feber, lymfadenopati, hepatosplenomegali, diaré og oppkast kan opptre ved de fleste former for TB, men kan også mangle.
Risikoen for å utvikle aktiv TB (inkl. disseminert/miliær TB og meningitt) etter primær infeksjon (smitte) er størst hos små barn (4), hvor sykdom kan utvikles allerede etter få uker.
Tabell 1. Risiko for å utvikle sykdom og sykdomslokalisasjon etter primærinfeksjon fordelt på aldersgrupper (4):
| Alder | Disseminert sykdom/meningitt | Lunge | Ingen sykdom |
| < 1 år | 10–20 % | 30–40 % | 50 % |
| 1–2 år | 2–5 % | 10–20 % | 75–80 % |
| 2–5 år | 0,5 % | 5 % | 95 % |
| 5–10 år | < 0,5 % | 2 % | 98 % |
| > 10 år | < 0,5 % | 10–20 % | 80–90% |
Funn på røntgen og CT thorax
- Ved aktiv PTB kan røntgenfunn variere, og er ofte uspesifikke.
- Front- og sidebilde av thorax bør tas mtp. hiluspatologi, som er det vanligste funnet.
- Små barn er utsatt for lymfobronkial obstruksjon med kollaps av lungevevet distalt for lymfeknutene.
- Tenåringer får oftere en mer «voksen type» PTB med kaverner, ev. pleural TB, med pleurafortykkelse og oftest pleuravæske (1,2).
- Pneumoniske parenkymforandringer kan forekomme i alle aldre. Ved store pneumoniske forandringer hos barn med TB behøver pasienten ikke være høyfebril og/eller medtatt, noe man ellers ville forventet ved tilsvarende røntgenforandringer hos et barn med en bakteriell pneumoni.
- Ved store/kompliserte lungeforandringer eller ved usikre funn, bør utredningen suppleres med CT thorax.
Diagnostikk og utredning
Tenk på TB som differensialdiagnose, spesielt ved uklare tilstander hos barn fra Afrika, Asia eller Øst-Europa!
Påvisning av M. tuberculosis-komplekset gir sikker diagnose, og bør tilstrebes. Bakteriemengden hos barn er lavere enn hos voksne, og derfor vil direkte mikroskopi ofte være negativ, og i flere tilfeller kan også PCR og dyrkning gi negativt resultat. Dermed må diagnostikken i større grad enn hos voksne baseres på en samlet vurdering av epidemiologi, sannsynlighet for eksposisjon, klinikk, radiologi og IGRA-test (1–3).
Direkte påvisning av M. tuberculosis-komplekset
- Dersom pasienten har normalt rtg. thorax, er sannsynligheten for PTB klart redusert.
- Annen utredning (og ev. CT thorax) vurderes før gastrisk aspirat, dersom andre diagnoser med fokus i lunger virker sannsynlige.
NB! Gastrisk aspirat og ekspektoratprøve bør gjennomføres i luftsmitteisolat.
A. Gastrisk aspirat anbefales som hovedmetode ved mistanke om PTB hos barn som ikke kan samarbeide om ekspektoratprøver (nedre alder for samarbeid til ekspektoratprøve oftest mellom 7 og 10 år). Det anbefales tre prøver tatt på forskjellige dager på morgenen før frokost. Dersom mikroskopi (påvisning av syrefaste staver) eller PCR er positiv i første eller andre prøve, er videre prøvetaking ikke nødvendig.
- Pasienten sederes lett, eksempelvis med midazolam.
- Nasogastrisk sonde plasseres. Klinisk/auskultatorisk plasseringskontroll.
- Mageinnholdet aspireres i en 50-ml sprøyte og overføres til en steril beholder.
- 50–75 ml sterilt vann (ikke saltvann) settes ned på sonden, hvoretter det påny aspireres. Dette aspiratet tilsettes det første.
- Nøytraliser oppsamlet væske med Na-bikarbonat 0,5 mmol/ml til pH 7 (urinstiks).
- Materialet sendes raskt til mikrobiologisk laboratorium for mikroskopi, dyrkning med resistensbestemmelse, PCR og eventuelt Xpert MTB/RIF; en PCR-basert hurtigtest, som også påviser genotypisk rifampicin-resistens.
B. Ekspektoratprøve er et alternativ til gastrisk aspirat, men forutsetter samarbeidende pasient og personale med erfaring. Be gjerne om bistand fra fysioterapeut. Minst 1 av 3 prøver skal være tatt om morgenen før frokost. Prøven må inneholde representativt materiale fra nedre luftveier (laboratoriet må vurdere tilstedeværelse av granulocytter ved mikroskopi). Prøven tas som spontant ekspektorat eller som indusert sputum, etter inhalasjon av 2–4 ml hyperton (2,9 %) saltvannsløsning: Natriumklorid 1 mmol/ml, 2 ml blandet med 2 ml av NaCl 9 mg/ml. Hos barn med respirasjonsvansker bør salbutamol inhaleres før inhalasjon av hypertont saltvann.
C. Bronkoskopi med bronkial lavage og biopsi kan være et alternativ, særlig hos barn der direkte mikroskopi og PCR av ekspektorat/gastrisk aspirat er negativt, og alvorlig sykdom med fokus i lunger krever sikker og rask diagnose. Pleurabiopsi er den mest sensitive metoden ved mistanke om pleuritt, og utføres med mindre direkte mikroskopi eller PCR er positiv i ekspektorat eller gastrisk aspirat (1).
Ved mistanke om EPTB er det type og lokalisasjon som avgjør hvilke prøver som skal tas. Man må alltid tilstrebe materiale (biopsi, aspirat) til dyrkning, PCR og histologi.
- Ved disseminert sykdom og meningitt vil oftalmoskopi kunne avsløre choroide tuberkler på netthinnen.
- Ved miliær TB (dvs. disseminert sykdom) må pasienten spinalpunkteres med tanke på TB meningitt uavhengig av om pasienten har CNS symptomer.
IGRA (Interferon-Gamma Release Assay)
IGRA-test er en blodprøve hvor pasientens T-celler stimuleres med definerte protein-antigener fra tuberkulosebakterien som induserer sekresjon av interferon-gamma fra ”effektor T-celler” dersom pasienten er smittet med TB. Antigenene som inngår i testene er spesifikke for M. tuberculosis-komplekset og er ikke tilstede i BCG-vaksinen eller i de fleste atypiske mykobakterier (med noen få unntak). IGRA-testene har dermed høyere spesifisitet (90–100 %) enn Mantoux test (13,14).
IGRA skiller ikke mellom latent og aktiv TB og predikerer i liten grad risikoen for utvikling av aktiv sykdom. IGRA er derimot et nyttig verktøy i smitteoppsporing og brukes først og fremst til å utelukke latent TB etter 1) eksponering for smitte eller 2) ved screening av innvandrere fra land med svært høy forekomst av TB. IGRA brukes også ved utredning av aktiv TB, selv om en negativ test ikke utelukker aktiv sykdom.
Sensitiviteten for IGRA-tester har tidligere vært best dokumentert hos barn > 5 år, og er da som hos voksne. To studier (6,7) viser imidlertid at IGRA-tester er pålitelig markører på TB-smitte også hos de minste barna, men vi anbefaler fortsatt en viss forsiktighet ved tolking av negativ IGRA-test hos særlig smitteeksponerte barn < 2 år. I denne alderen forekommer også en høyere andel inkonklusive tester, viser til avsnittet nedenfor, samt avsnitt B2.
Det finnes to tilgjengelige IGRA-tester:
- QuantiFERON® TB Gold Plus: Enklest og billigst. Tilgjengelig ved alle sentrale laboratorier ved Helseforetakene. Anbefalt som primær IGRA-test. En inkonklusiv QuantiFERON® TB Gold Plus forekommer hyppigere ved immunsuppresjon, og hos barn < 2 år. Ved inkonklusiv test anbefales det å gjenta prøven. Dersom fortsatt inkonklusiv test anbefales det som hovedregel å supplere med T-SPOT.TB®.
- T-SPOT.TB®: Har en mer omstendelig prosedyre enn QuantiFERON® TB Gold Plus, og er bare tilgjengelig ved Folkehelseinstituttet. Instruks for innsending av tuberkuloseprøve til T-spotanalyse ved Folkehelseinstituttet - FHI.
Behandling og oppfølging
A. Behandling av aktiv TB
Dersom utredning (en samlet vurdering av epidemiologi, klinikk, radiologi og ev. IGRA-test) gir mistanke om aktiv TB, skal behandling startes, etter at adekvat mikrobiologisk prøvetaking er gjort, selv om ikke diagnosen er mikrobiologisk verifisert (resultat av dyrkning med resistensbestemmelse kan foreligge først etter opptil 6 uker).
Dersom det ikke foreligger opplysninger som gir mistanke om multiresistent TB, startes behandling med fire medikamenter: Isoniazid, rifampicin, pyrazinamid og etambutol.
Tabell 2. Dosering og administrasjon ved behandling av aktiv TB hos barn
| Medikament (generisk navn) | Daglig dose peroral medisin |
| Isoniazid | 10 (7–15) mg/kg |
| Rifampicin | 15 (10–20) mg/kg |
| Pyrazinamid | 35 (30–40) mg/kg |
| Etambutol | 15–20 mg/kg |
Standard behandlingslengde ved PTB og EPTB (unntatt ved meningitt, disseminert (miliær)- eller bein/leddtuberkulose) er 6 måneder.
- De første 2 måneder (intensivfasen) brukes 4 medikamenter, men dersom resistensbestemmelse påviser fullt følsom stamme, kan som oftest etambutol seponeres før endt intensivfase. Dersom det er påvist følsom stamme hos sikker smittekilde, kan man som oftest utelate etambutol fra intensivfasen. NB! Ved store lungeforandringer, for eksempel ved kaverner, bør alle 4 medikamentene inkluderes i hele intensivfasen, selv om stammen er fullt følsom.
- Ved fullt følsom stamme gis kun rifampicin og isoniazid som standardbehandling de 4 siste månedene.
Forkortet behandling ved «ikke alvorlig TB» hos pasienter < 16 år
- I «WHO consolidated guidelines on tuberculosis, Module 5» fra 2022 anbefales et forkortet behandlingsregime ved «ikke alvorlig TB» uten mistanke om resistens hos barn og ungdom under 16 år (> 3 md.): Intensivfase med isoniazid, rifampicin, pyrazinamid (og etambutol) i 2 måneder etterfulgt av isoniazid og rifampicin i 2 måneder.
- Definisjon av «ikke alvorlig TB» er at pasienten har milde kliniske symptomer uten pustebesvær, høy feber, alvorlig redusert allmenntilstand eller alvorlig underernæring, og enten har
- Perifer lymfeknute TB,
- Intrathorakal lymfeknute TB uten obstruksjon av luftveier,
- Ukomplisert TB pleuraeffusjon eller
- PTB begrenset til en lungelapp med lavt bakterietall (mikroskopi negativ) uten kaverner eller miliært preg
- Ved utilfredsstillende behandlingsrespons må behandlingen forlenges (standard behandling 6 måneder) samtidig som differensialdiagnoser eller andre årsaker til terapisvikt må vurderes.
- Pasientene bør følges opp i 12 måneder etter avsluttet 4 måneders regime.
Ved miliær-TB og bein/ledd-TB er standard behandlingslengde 12 måneder med 4 medikamenter i intensivfasen, selv ved fullt følsom stamme. En viss forlengelse av behandlingen kan også vurderes ved omfattende PTB. Diskuter med kollega med erfaring i behandling av TB.
Ved TB-meningitt anbefales 12 måneders total behandlingstid og 4 medikamenter i intensivfasen (2 md.), selv ved fullt følsom stamme (9).
- I intensivfasen anbefales høyere doser av isoniazid (10–15 mg/kg/d, maks 300 mg) og rifampicin (20–30 mg/kg/d, maks 600 mg), og vanlige doser som ved PTB i 10 md.
- Penetrasjon av etambutol til CNS er dårlig, og man kan i intensivfasen vurdere å erstatte etambutol med levofloxacin 15–20 mg/kg/d.
- Det anbefales også kortikosteroider i startfasen av behandlingen: Prednisolon 2–4 mg/kg/d (maks 60 mg/d) i 4 uker etterfulgt av gradvis nedtrapping over ytterligere 4 uker.
Kortikosteroider anbefales også ved TB perikarditt og kan vurderes ved endobronkial TB-sykdom (okklusjon av bronkier og atelektase), pleuraeffusjon, alvorlig disseminert sykdom (alveolokapillær blokk) og abdominal tuberkulose: Prednisolon 2 mg/kg (maks 40 mg) i 4 uker, deretter gradvis nedtrapping over 4 uker. Andre (ev. i.v.) kortikosteroider i ekvivalente doser kan også brukes.
Tuberkulosemidler forskrives på H-resept siden 2025.
Isoniazid-monoresistent TB
Ved behandling av isoniazid-monoresistent TB gis oftest behandling med 4 medikamenter i 6 md. (Tabell 3) Ved alvorlig sykdom i 9 md. Diskuter med spesialist.
- Man kan vurdere å stoppe pyrazinamid noe tidligere.
- Grunnen til at levofloxacin velges fremfor moxifloxacin, er at kombinasjonsbehandling med rifampicin og moxifloxacin gir 30 % redusert serumkonsentrasjon av moxifloxacin.
- For små barn, kan levofloxacin (Tavanic®) 500 mg deles i to ev. fire deler. Ønsket mengde legges i en peroral sprøyte, og trekkes opp 5–10 ml vann. Levofloxacin mikstur produseres ved Ullevål sykehusapotek.
Tabell 3. Dosering og administrasjon ved behandling av isoniazid-monoresistent TB hos barn (15).
| Medikament (generisk navn) | Daglig dose peroral medisin |
| Rifampicin | 15–20 mg/kg (< 50 kg: maks 450 mg og > 50 kg: maks 600 mg) |
| Pyrazinamid | 35–40 mg/kg (< 50 kg: maks 1,5 g og > 50 kg: maks 2 g) |
| Etambutol | 15–25 mg/kg (maks 1,6 g) |
| Levofloxacin | 20 (15–22) mg/kg |
Multiresistent tuberkulose (MDR-TB; resistens mot rifampicin og isoniazid)
- Svært sjelden hos barn i Norge. Risikofaktorer for MDR-TB er tidligere gjennomgått TB-behandling og smittested i tidligere Sovjetstater (ca. 20 % MDR-TB hos nysmittede), inkludert i Ukraina (24 % MDR-TB hos nysmittede).
- Genotypiske tester for rifampicin- (og isoniazid) resistens er tilgjengelig ved en del laboratorier. FHI utfører utvidet genotypisk og fenotypisk resistenstesting. Testene kan utføres på kultur og direkte i prøvemateriale. Isolert rifampicin-resistent TB er sjelden og behandles oftest som MDR-TB.
- Fra 2022 har WHO anbefalt nye kortere per orale behandlingsregimer (6–9 måneder) som har meget god effekt. Til pasienter > 14 år er BPaL(M) førstevalg: Bedakvilin, pretomanid, linezolid og moksifloxacin i kombinasjon.
- Fra 2024 har WHO anbefalt nye per orale behandlingsregimer som også kan benyttes hos barn under 14 år: Bedakvilin, delamanid, linezolid, klofazimin og levofloxacin startes i kombinasjon. Ved bekreftet følsomhet for fluorokinoloner (levofloxacin) kan klofazimin seponeres. Levofloxacin seponeres ved resistens og klofazimin kontinueres.
- Behandlingsregimene er ofte beheftet med bivirkninger. Ved resistens mot de anbefalte midlene eller ved (alvorlige) bivirkninger, må alternative midler benyttes. Behandling av MDR-TB må skje i samarbeid med barnelege og/eller vokseninfeksjonslege med erfaring.
- Ved påvisning av eller mistanke om MDR-TB skal pasienten behandles ved sykehus utpekt av det regionale helseforetaket.
Tabell 4. Aktuelle perorale medikamenter. OBS: I perioder har det vært mangel på en rekke tuberkulosepreparater. TB-koordinator kontaktes for oppdatert forsyningsstatus.
| Tabletter/Kapsler | Virkestoffer | Reg./Ureg. |
| Rimactan®, kaps. 150 mg og 300 mg | Rifampicin | R |
| Priftin®, tabl. 150 mg | Rifapentin | U |
Isozid® tabl. 100 mg | Isoniazid | U |
Isoniazid tabl. 300 mg (Teva) | Isoniazid | U |
Pyrazinamid®, tabl. 500 mg | Pyrazinamid | U |
EMF-Fatol® tabl. 100 mg og 400 mg | Etambutol | U |
Tavanic®, tabl. 500 mg | Levofloxacin | U |
| Kombinasjonspreparater | ||
| Rimstar® tabl. | Rifampicin 150 mg + Isoniazid 75 mg + Pyrazinamid 400 mg + Etambutol 275 mg | R |
Voractiv® tabl. | Rifampicin 150 mg + Isoniazid 75 mg + Pyrazinamid 400 mg + Etambutol 275 mg | U |
| Rifater® tabl. | Rifampicin 120 mg + Isoniazid 50 mg + Pyrazinamid 300 mg | U |
| Rimactazid® tabl. | Rifampicin 150 mg + Isoniazid 75 mg | R |
| Rifinah® 150/100 tabl. | Rifampicin 150 mg + Isoniazid 100 mg | U |
Rifinah® 300/150 tabl. | Rifampicin 300 mg + Isoniazid 150 mg | U |
| Miksturer | ||
Rifadin® | Rifampicin 20 mg/ml | U |
Isoniazid | Isoniazid 20 mg/ml | Apotekprodusert |
Pyrazinamid | Pyrazinamid 100 mg/ml | Apotekprodusert |
Etambutol | Etambutol 50 mg/ml | Apotekprodusert |
| Levofloxacin | Levofloxacin 50 mg/ml | Apotekprodusert |
Særlige momenter ved TB-behandling av barn
- Direkte observert behandling (DOT) anbefales i hele behandlingsperioden. Helsepersonell eller andre spesielt opplærte personer utenom nær familie, skal da observere at medikamentene inntas. Dette organiseres av TB-koordinator i samarbeid med primærhelsetjenesten.
- Kombinasjonspreparater anbefales der disse er tilgjengelig i tilpasset dosering. Som hovedregel kan dosen rundes opp for å tilpasses tablettstyrke. Dette gjelder ikke etambutol hvor dosen må beregnes så nøyaktig som mulig grunnet risiko for toksisitet.
- Ved isoniazid-behandling og aktiv TB anbefales det å gi pyridoksin-tilskudd for å unngå perifer nevropati, 10 mg pyridoksin per 100 mg isoniazid. Pyridoksin mikstur 10 mg/ml kan spesialproduseres på apotek. Doseringsforslag, tabletter 40 mg: < 20 kg: ¼ tabl = 10 mg daglig. > 20 kg: ½ tabl = 20 mg daglig. Ved forebyggende behandling anbefales isonaizid kun til underernærte barn, barn som fullammes, barn med dårlig regulert diabetes, eller gravide.
- Foreldrene og barn må orienteres om at rifampicin og rifapentin farger urin og andre kroppsvæsker oransje.
- Dersom symptomer som hudkløe, vedvarende kvalme/slapphet eller gule øyne/hud, må foreldre ta kontakt med lege, gjerne via personalet som utfører DOT.
- Blodprøver med tanke på hematologi, lever- og nyrefunksjon tas før behandling iverksettes (11). Gjelder også forebyggende behandling. Hvis normale prøver og ingen kjent lever- eller nyresykdom, tas nye prøver kun på klinisk indikasjon, for eksempel ved symptomer nevnt i punktet over.
- Barn tolererer vanligvis TB-behandling bedre enn voksne. Ved ev. utvikling av hepatitt kan dette skyldes pyrazinamid > isoniazid > rifampicin > etambutol. Se Metodebok i infeksjonsmedisin (for voksne) vedr. håndtering av bivirkninger.
- Viktigste bivirkning ved etambutol-behandling er optikusnevritt som kan være ensidig og opptre når som helst under behandlingen. Symptomene er nedsatt synsskarphet, synsfeltutfall og endret fargesyn. Fordi dette er vanskelig å erkjenne, særlig hos små barn, anbefales øyelegeundersøkelse og måling av VEP før oppstart av etambutolbehandling, og etter en 1 måned, for å avsløre utvikling av optikusnevritt i reversibel fase. Dersom barnet kan samarbeide for testing av syn/fargesyn, og behandlende lege eller TB-koordinator har erfaring med testing, kan dette erstatte øyelegeundersøkelse, men barnet må henvises umiddelbart til øyelege ved avvikende funn. For pasienter som kontinuerer etambutolbehandling utover 2 md., anbefales vurdering av syn som vist over, hver måned.
- Behov for polikliniske legekontroller: Som minimum etter 1 md. og ved avslutning av behandling. Hyppigere kontroller på klinisk indikasjon. Pga. DOT sees pasientene regelmessig av helsepersonell som kan rapportere til behandlingsansvarlig lege ved symptomer eller bivirkninger.
Smittevern i sykehus
Mistanke om eller påvist EPTB er ikke smittsom og trenger ikke isolasjonstiltak, med mindre det utføres aerosoldannende prosedyrer på det affiserte organet.
Mistanke om eller påvist PTB (ikke MDR-TB):
- Luftsmitteisolering med bruk av FFP3-klassifisert åndedrettsvern for personell som håndterer pasienten. Dersom pasienten kortvarig må ut fra luftsmitteisolatet, skal han/hun påføres kirurgisk munnbind. Luftsmitteisoleringen opprettholdes som et minimum til smittestatus er avklart.
- Dersom det påvises syrefaste staver ved direkte mikroskopi av sputum/gastrisk aspirat, regnes pasienten som smittsom. Ved god klinisk behandlingsrespons etter 14 dager (bedring av symptomer og tegn, bedring i blodprøver) regnes pasienten som svært lite smittsom selv om mikroskopi fortsatt er positiv. Isolasjonen kan da som hovedregel oppheves dersom pasienten skrives ut. Isolasjonen må opprettholdes hvis pasienten fortsatt trenger å være innlagt, og det behandles pasienter med alvorlig immunsvikt ved samme avdeling (Se kap om TB i Smittevernhåndboka Tuberkulose - FHI).
- Hjemme-isolering kan være et alternativ til sykehusisolering, både ved smittsom TB før 14 dager behandling er gitt, eller ved tvil om smittsomhet etter at 14 dagers behandling er gitt. Se Tuberkulose - FHI.
- Ubehandlede pasienter med negativ direkte mikroskopi i minst to sputumprøver (derav minst en morgenprøve)/gastriske aspirat, eller i en prøve fra BAL, regnes også som svært lite smittsomme. Isolasjonen kan oppheves når prøvesvar foreligger og pasienten kan skrives ut. Isolasjonen må opprettholdes dersom pasienten fortsatt trenger å være innlagt og det behandles pasienter med alvorlig immunsvikt på samme avdeling. Pasienten kan da avisoleres etter 14 dager, såfremt det er klinisk bedring.
NB: Dersom en mulig eller sikker voksen smittekilde ledsager barnet under innleggelsen, må isolering ved luftsmitte og bruk av åndedrettsvern iverksettes, uavhengig av barnets sykdomsstatus.
Mistanke om eller påvist multiresistent PTB:
Luftsmitteisolering med FFP3-godkjente masker. Det stilles ekstra strenge krav til oppheving av isolering. Som kontroll på behandlingseffekt anbefales ukentlig direkte mikroskopi og dyrkning av luftveisprøver. Isolasjonstidens lengde må individualiseres. Se Tuberkulose - FHI.
B. Forebyggende behandling
Gjelder friske personer uten tegn til aktiv sykdom i følgende situasjoner:
B1. Latent tuberkulose = Positiv IGRA test, men uten kliniske eller radiologiske tegn på aktiv tuberkulose (ICD-kode: Z22.7)
Barn med latent TB < 15 år og særlig < 5 år bør tilbys behandling med mindre det er tungtveiende grunner for ikke å gjøre det, fordi små barn blir raskere og oftere syke, og i større grad utvikler meningitt eller desiminert/miliær sykdom.
Hvis tilbudet om behandling avslås, anbefales årlig radiologisk og klinisk kontroll i 2–3 år.
I en norsk studie viste man at risikoen for å utvikle aktiv sykdom ved latent TB, stiger med økende verdi av IGRA, men ikke vesentlig ved nivåer > 4 IU/ml (12). Ved nivåer fra 0,35–1 IU/ml kan man vurdere å kontrollere prøven, men ikke dersom prøven er tatt pga. antatt nysmitte; da skal forebyggende behandling iverksettes.
Standardregime for forebyggende behandling var tidligere isoniazid i 6 måneder.
En 3 mds. kombinasjon av isoniazid og rifampicin har tilsvarende effekt, og gitt halvert behandlingstid, anbefales dette regimet foran monoterapi med isoniazid. Anbefalte doser: isoniazid 10 mg/kg/d (maks 300 mg) og rifampicin 10–15 mg/kg/d (maks 600 mg).
Et alternativ som anbefales brukt dersom mulig å gjennomføre, er ukentlig behandling med rifapentin og isoniazid i 3 md. (Tabell 5). Denne kombinasjonen anses som likeverdig med daglig behandling, og kan benyttes helt ned til 2 års alder. Rifapentin (Priftin®) tabletter) kan da knuses og løses i mat med myk konsistens. Ved ukentlig behandling, skal det alltid gjennomføres DOT.
| Tabell 5. WHO’s anbefalinger om dosering basert på kroppsvekt ved ukentlig forebyggende behandling med rifapentin og isoniazid i 12 uker | |||||||||
| Vekt (kg) | 10–14,9 | 15–19,9 | 20–24,9 | 25–29,9 | 30–34,9 | 35–39,9 | 40–44,9 | 45–49,9 | > 50 |
| Isoniazid | 250 mg | 300 mg | 450 mg | 450 mg | 600 mg | 600 mg | 750 mg | 750 mg | 900 mg |
| Rifapentin | 300 mg | 450 mg | 600 mg | 600 mg | 750 mg | 900 mg | 900 mg | 900 mg | 900 mg |
Latent TB etter eksponering for smittekilde med resistent TB (MDR-TB)
Ved bekreftet smitte (positiv IGRA) etter nærkontakt med MDR-TB indeks-pasient med fluorokinfølsom stamme anbefales i de fleste tilfeller forebyggende behandling med Levofloxacin 15–20 mg/kg/dag i 6 md. Det åpnes dog for individuell vurdering (avhengig av grad av eksponering, sårbarhet for utvikling av sykdom og risiko for bivirkninger).
OBS. bivirkninger: Kvalme, artralgi, tendinitt, forlenget QTc (spesielt i kombinasjon med andre medikamenter som kan gi forlenget QT-tid). Det anbefales EKG før oppstart av behandling og hver 4.–6. uke under behandlingen. Det anbefales behandling i samarbeid med barnelege eller vokseninfeksjonslege med erfaring. Det anbefales oppfølging hver 6. md tom. 2 år fra siste eksponering uavhengig av om forebyggende behandling gis.
B2. Smitteoppsporing og tiltak ved eksponering for smitteførende person
Ved eksponering for smitte må først aktiv TB utelukkes ved anamnese, undersøkelse og rtg. thorax. Alle eksponerte som har symptomer eller røntgenfunn som gir mistanke om aktiv TB, skal utredes umiddelbart. FHI har utarbeidet flytskjema som gir en praktisk veiledning i hvordan man forholder seg ved slike situasjoner Flytskjema tuberkulose - for undersøkelse og smitteoppsporing - FHI.
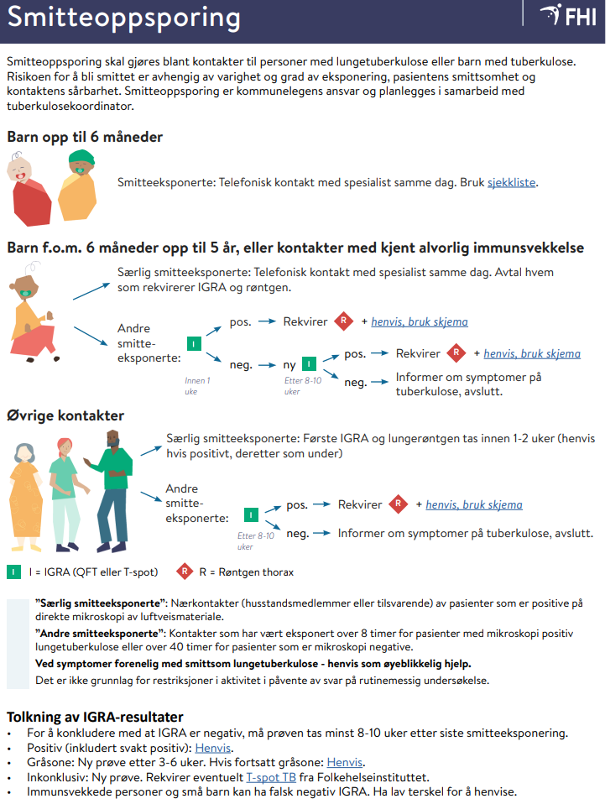
Pga. økt risiko for rask utvikling av alvorlig TB-sykdom hos barn < 2 år, anbefales det for ”særlig smitteeksponerte” (= barn som er eksponert for mikroskopi-positiv nærkontakt) å starte forebyggende behandling med isoniazid og rifampicin før det er avklart om barnet er smittet (13). Dersom forebyggende behandling er startet, og IGRA er negativ 8–10 uker etter siste smitteeksponering, kan man vurdere å avslutte behandlingen. I praksis vil man ofte fullføre 3 md. behandling hos nærkontakter < 2 år med stor grad av eksponering. Barn < 6 md. med slik eksponering, skal alltid fullføre 3 md. forebyggende behandling uavhengig av IGRA-resultat.
Vurdering av vaksinasjonsstatus: Fra 2009 tilbys BCG-vaksine i barnevaksinasjonsprogrammet ved 6 ukers alder, til barn med en eller to foreldre fra land med høy forekomst av TB. Arr etter BCG-vaksinasjon er en indikasjon på vaksinens aktivering av T-cellene. Dette er korrelert til vaksinens beskyttende effekt. Det finnes likevel indikasjoner på at man har en viss grad av beskyttelse på tross av manglende arr. Usikker vaksinasjonsstatus og manglende arr styrker indikasjonen for forebyggende behandling (14).
Tuberkulosekoordinator
Hvert regionalt helseforetak har utpekt TB-koordinator(er). TB-koordinator bør kontaktes tidlig når man har diagnostisert en pasient med TB, får henvist en pasient med spørsmål om TB eller planlegger å starte forebyggende behandling. TB-koordinator kan bistå med prøvetaking, skriver behandlingsplan sammen med ansvarlig barnelege, organiserer behandlingsplanmøter med pasient/pårørende, barnelege og primærhelsetjenesten.
”MSIS-melding tuberkulose” sendes ved påvist tuberkulose og/eller start av behandling, også ved start av forebyggende behandling. Ved avslutning av behandling etter 6–9 md. sendes skjema ”MSIS-melding behandlingsresultat tuberkulose”. Dette skjemaet skal også sendes etter 6–9 md. selv om behandlingen forlenges, og nytt skjema sendes når forlenget behandlingen avsluttes.
Referanser og litteratur
- Tuberkulose - Håndbok for helsepersonell, Smittevernhåndboka Tuberkulose - FHI
- Perez-Velez, et al. Tuberculosis in Children. N Engl J Med 2012; 367:348-61
- Newton SM, et al. Paediatric tuberculosis. Lancet Infect Dis 2008; 8:498-510 4
- Marais BJ, et al. The natural history of childhood intra-thoracic tuberculosis: a critical review of literature from the pre-chemotherapy era. Int J Tuberc Lung Dis 2004; 8:392-402
- Starke JR. Interferon-γ release assays for diagnosis of tuberculosis infection and disease in children. Pediatrics 2014; 134:e1763-73
- Laurenti, et al. Performance of interferon-γ release assays in the diagnosis of confirmed active tuberculosis in immunocompetent children: a new systematic review and meta-analysis. BMC Infectious Diseases 2016, 16:131.
- Ahmed A, et al. Interferon-g Release Assays in Children < 15 Years of Age. Pediatrics. 2020; 145:e20191930.
- Howley, et al. Evaluation of QuantiFERON-TB Gold In-Tube and Tuberculin Skin Tests Among Immigrant Children Being Screened for Latent Tuberculosis Infection. Pediatr Infect Dis J. 2015 January; 34(1):35-39.
- Thwaites G, et al. British Infection Society guidelines for the diagnosis and treatment of tuberculosis of the central nervous system in adults and children. J Infect 2009; 59:167-87.
- Fregonese F, et al. Comparison of different treatments for isoniazid-resistant tuberculosis: an individual patient data meta-analysis. Lancet Respir Med 2018; 6:265-75.
- Kunst K. Age-related risk of hepatotoxicity in the treatment of latent tuberculosis infection: a systematic review. Int J Tuberc Lung Dis 1. 2010.
- Winje BA, et al. Stratification by interferon-γ release assay level predicts risk of incident TB. Thorax 2018; 73:652-61.
- Erkens C, et al. Tuberculosis contact investigation in low prevalence countries: a European consensus. Eur Respir J 2010; 36:925-94
- BCG vaccination at three different age groups: response and effectiveness. Journal of Immune Based Therapies and Vaccines 2005; 3:1.
- American Thoracic Society/Centers for Disease Control and Prevention/Infectious Diseases Society of America: Treatment of Tuberculosis. Am J Respir Crit Care Med 2003; 167:603-62.
- National Collaboration Centre for Chronic Conditions. Tuberculosis: clinical diagnosis and management of tuberculosis, and measures for its prevention and control. London: Royal College of Physicians, 2006
- Berti, et al. Tuberculosis in childhood: a systematic review of national and international guidelines. BMC Infectious Diseases. 2014; 14(Suppl 1):S3
- WHO consolidated guidelines on tuberculosis. Module 5: Management of tuberculosis in children and adolescents, 2022. 9789240046764-eng.pdf
- WHO consolidated guidelines on tuberculosis. Module 1: Tuberculosis preventive treatment, 2024. WHO consolidated guidelines on tuberculosis: tuberculosis preventive treatment.
Tidligere versjoner
Versjon 2006: Karl-Olaf Wathne, Martin Handeland
Revidert versjon 2009: Per Kristian Knudsen, Aud Berstad, Claus Klingenberg
Justert versjon 2011: Per Kristian Knudsen, Henrik Døllner, Claus Klingenberg
Revidert versjon 2014: Per Kristian Knudsen, Henrik Døllner, Claus Klingenberg, Astrid Rojahn
Revidert versjon 2017: John Espen Gjøen, Per Kristian Knudsen, Henrik Døllner, Claus Klingenberg, Astrid Rojahn
Revidert versjon 2021: John Espen Gjøen, Per Kristian Knudsen, Henrik Døllner, Claus Klingenberg, Astrid Rojahn










