Generell veileder i pediatri
7. Øvre og nedre luftveier
7.8.2 Astma bronkiale – Barn og ungdom i alder 6–18 år
Sist faglig oppdatert: 16.12.2025
Ingvild Bruun Mikalsen, Knut Øymar, Carina Madelen Saunders og Torbjørn Nag
Forkortelser brukt i dette avsnittet:
- AIR: Anti-inflammatory reliever. Bruk av kombinasjonspreparat ICS-formeterol som anfallskuperende behandling.
- EILO: Exercise induced laryngeal obstruction
- ICS: Inhalasjonssteroid
- LABA: Langtidsvirkende β2-agonist
- LAMA: Langtidsvirkende muskarinreseptorantagonist
- LTRA: Leukotrienreseptorantagonist
- MART: Maintenance and Reliever Therapy. Bruk av kombinasjonspreparat ICS-formoterol både fast og ved behov.
- PEF: Peak ekspiratorisk flow
- SABA: Kortidsvirkende β2-agonist
- SAMA: Kortidsvirkende muskarinreseptorantagonist
Bakgrunn
Astma er den vanligste kroniske sykdommen hos barn og unge. Det er en tilstand som vanligvis karakteriseres av en kronisk inflammasjon i luftveiene, og defineres ut fra respiratoriske symptomer som varierer over tid og i intensitet, sammen med en variabel ekspiratorisk luftveisobstruksjon.
Astma er en heterogen tilstand med mange ulike fenotyper og ulikheter i symptommønster, patofysiologi, genetikk og prognose. Det er ingen helt klare diagnostiske kriterier, og avgrensingen mot andre tilstander i luftveiene kan være vanskelig.
Sammenlignet med yngre barn, som kan ha ulike årsaker til nedre luftveisobstruksjon, er astma den vanligste årsaken til nedre luftveisobstruksjon hos barn og ungdom i alderen 6–18 år. Hos eldre barn er det også flere objektive tester som kan brukes til å understøtte en astmadiagnose.
Gjennom årene har mange ulike inndelinger og astmafenotyper vært foreslått. De siste årene har det spesielt vært fokus på Th2 høy og Th2 lav astma fenotype. Ved Th2 høy fenotype dominerer eosinofil inflammasjon i luftveiene. Fenotypen er oftere assosiert med allergisk sensibilisering, allergi og atopisk eksem, og er oftere persisterende. Pasientene vil vanligvis ha god effekt av inhalasjonssteroider (ICS). Ved Th2 lav fenotype dominerer nøytrofil inflammasjon i luftveiene. Hos disse pasientene er effekten av ICS ofte mindre. Inndeling i Th2 høy og Th2 lav astmafenotype er særlig aktuelt ved alvorlig astma og vurdering av biologisk behandling.
Dette kapittelet tar primært utgangspunkt i retningslinjer fra GINA 2025 (3) som oppdateres jevnlig. For utfyllende informasjon henvises det til disse.
Viser også til eget kapittel for astma hos barn ≤ 5 år.
Symptomer og funn
Hovedfunnene ved astma er gjentatte episoder med nedre luftveisobstruksjon og forlenget ekspirium. Ofte utløses symptomene av triggere som luftveisinfeksjoner, allergeneksponering, fysisk aktivitet, luftforurensning eller tobakksrøyk. Symptomene varierer gjennom dagen, og er ofte mest uttalt om kvelden og om morgenen.
- Forlenget pipende ekspirium: Tilbakevendende nedre luftveisobstruksjon med høyfrekvente ekspiratoriske pipelyder (engelsk wheeze), både i våken tilstand og under søvn.
- Hoste: Tilbakevendende eller persisterende tørr hoste ofte mest uttalt om natten/tidlig morgen eller opptrer sammen med andre symptomer som forlenget pipende ekspirium eller tung pust. I forbindelse med luftveisinfeksjoner kan hosten også forbigående være våt. Ved hoste som eneste symptom er astma mindre sannsynlig, spesielt hos ikke-atopiske barn og ungdom.
- Tung pust: Periodevis følelse av ikke å få nok luft, rask respirasjonsfrekvens, inndragninger, bruk av aksessorisk muskulatur eller nesevingespill.
- Redusert aktivitetsnivå: Passive barn som ikke springer, leker eller ler med samme intensitet som andre barn. Barn som blir fort slitne.
- Forverring av symptomer etter fysisk aktivitet
- Symptomene trigges eller forverres av virale infeksjoner
I symptomperioder kan det observeres forlenget ekspirium, oppheiste skuldre og inndragninger. Ved lungeauskultasjon høres ofte forlenget ekspirium og polyfone høyfrekvente endeekspiratoriske pipelyder, spesielt ved forsert ekspirasjon. Tilstanden er variabel, og ofte er det normale funn ved lungeauskultasjon mellom symptomperiodene. Det kan derfor ofte være aktuelt å ta inn barnet til en ekstra undersøkelse når det har symptomer og/eller at foreldrene filmer barnet når det har symptomer.
Diagnostikk og utredning
Diagnosen stilles på bakgrunn av symptomer, klinisk undersøkelse, objektive tester og respons på behandling.
Spirometri forsøkes på alle barn fra ca. 5 års alder (gjerne tidligere hos barn med kroniske luftveissymptomer) (se kap. 7.3.3). Funn som tyder på astma er:
- Luftveisobstruksjon med redusert FEV1/FVC ratio < 2 SD. Kurven vil ofte få en «hengkøyefasong».
- Reversibilitet etter inhalasjon av bronkodilator (vanligvis en ẞ2-agonist), med en økning av FEV1 som tilsvarer > 12 % av den predikerte verdien.
- Bedring etter 4 uker med inhalasjonssteroider med en økning i baseline FEV1 som tilsvarer > 12 % av den predikerte verdien.
Vurder alltid tallene sammen med formen på spirometrikurvene (teknisk utførelse) for å se om resultatene ser reelle ut. Redusert hastighet i starten av ekspirasjonen gir falsk lav FEV1 og FEV1/FVC ratio. Tidlig avslutning av ekspirasjon gir falsk lav FVC og høy FEV1/FVC ratio. Sjekk alltid volum-tid kurven for å vurdere om pasienten har nådd platåfase med lang nok ekspirasjon. Ikke maksimal inspirasjon gir lav FVC og FEV1. Spirometri vil ofte være normal i symptomfrie perioder.
Ved usikkerhet om diagnosen hos barn som kan blåse reproduserbare spirometrikurver kan provokasjonstester være aktuelle. EIB-test (se kap. 7.4) har lav sensitivitet, men høy spesifisitet, det vil si at en negativ test utelukker ikke astma. Metakolin-provokasjon (se kap. 7.5) har høy sensitivitet, men lav spesifisitet som betyr at en negativ test utelukker i praksis astma. En positiv metakolin-provokasjon test alene er ikke diagnostisk for astma, men betydelig bronkial hyperreaktivitet øker sannsynligheten for astma.
Måling av nitrogenoksid i ekspirasjonsluft (FeNO) kan vurderes ved diagnostisk usikkerhet (se kap. 7.3.5). Høy FeNO alene er ikke diagnostisk for astma, men et nivå over 35 ppb (barn 6–11 år) og over 50 ppb (> 12 år) kan tyde på type 2 inflammasjon (Th2 høy astma fenotype) i luftveiene. Dette øker sannsynligheten for astma og ICS-effekt. Forhøyet nivå av eosinofile i blod > 0,3 x 109/L er også en viktig biomarkør ved astma. Lav FeNO eller lave eosinofile i blod kan ikke brukes som argument mot astmadiagnose eller mot å starte behandling med ICS. Måling av FeNO og eosinofile i blod bør gjøres før oppstart av biologisk behandling, og kan trolig predikere respons på noen typer biologisk behandling. Vedvarende høy FeNO eller høye eosinofile hos pasienter som behandles med ICS øker risikoen for eksaserbasjoner.
Hjemmespirometri kan påvise luftveisobstruksjon i perioder med symptomer og styrke en astmadiagnose. Alternativt kan Peak Expiratory Flow (PEF)-målinger benyttes over tid (for eksempel 2 ganger daglig i 2–4 uker). Dersom god teknikk vil stor variasjon i PEF-målinger kunne tolkes som en variabel luftveisobstruksjon og støtte diagnosen. Hjemmespirometri og PEF-målinger kan i noen tilfeller også brukes til å styre behandlingen ved forverringer.
Prikktest eller spesifikt IgE i serum anbefales ved mistanke om astma for å kartlegge atopisk disposisjon og for å identifisere triggere (se kap 6.6). De aller fleste skolebarn med astma har allergisk sensibilisering, og påvisning av dette øker sannsynligheten for astma og effekt av ICS-behandling.
Ved usikkerhet om diagnosen er prøvebehandling med ICS i 1–3 måneder aktuelt. Ved evalueringen kan både bedring av symptomer og lungefunksjon styrke en astmadiagnose. Bedring med en økning i baseline FEV1 som tilsvarer > 12 % av den predikerte verdien etter en periode med ICS er diagnostisk for astma. Hos pasienter som får astmabehandling der det er tvil om diagnosen, bør behandlingen alltid seponeres for å bekrefte effekt.
Differensial diagnoser
Luftveisinfeksjoner, EILO, hyperventilasjon/dysfunksjonell pusting, trakeobronkomalasi, inhalert fremmedlegeme, cystisk fibrose, primær ciliedyskinesi, bronkiektasier, bronkopulmonal dysplasi, medfødt hjertesykdom, gastroøsofagal refluks sykdom.
Behandling og oppfølging
Mål for behandlingen er
- God kontroll over astmasymptomer og et normalt aktivitetsnivå
- Normal lungefunksjon
- Minimal risiko for periodevise forverringer (eksaserbasjoner) og bivirkninger
Astmakontroll vurderes ut fra symptomer siste 4 uker og risiko for eksaserbasjoner. Tabell 1 under er hentet fra GINA guidelines og kan brukes for å kartlegge barnets symptomer siste 4 uker.
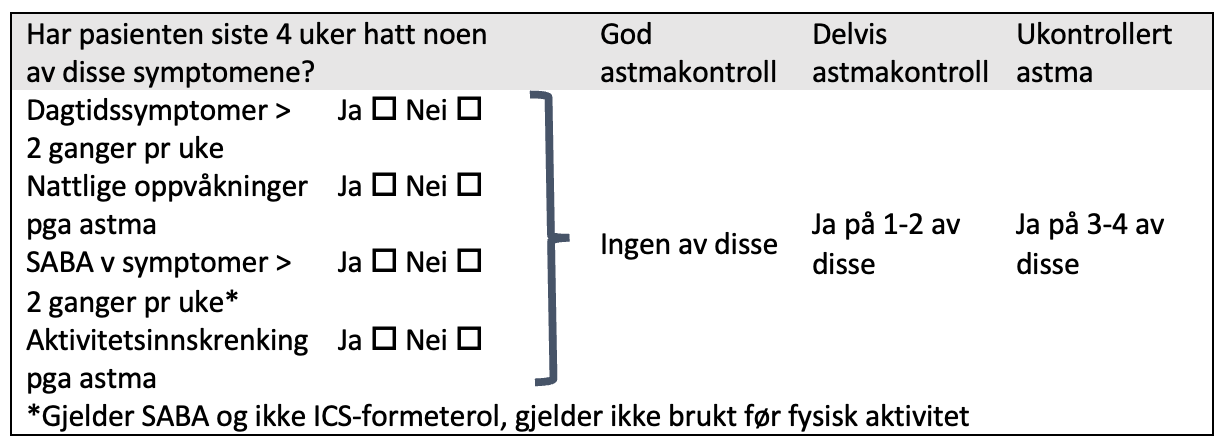
I tillegg er det viktig å vurdere risikofaktororer for eksaserbasjoner slik som stort overforbruk av SABA, dårlig etterlevelse av ICS, andre medisinske tilstander, lav lungefunksjon, eksponering for tobakksrøyk eller annen luftforurensing og tidligere alvorlige eksaserbasjoner.
Ikke farmakologisk behandling
- Dårlig luftkvalitet kan forverre astmasymptomer, og bør kartlegges hos alle pasienter.
- Røyking må unngås.
- Dyrehår kan gi forverring av symptomer hos pasienter med allergi, og eksponering bør da unngås. Fjerning av dyr hos pasienter uten allergi (inkludert sensibiliserte pasienter) har ikke vist overbevisende effekt i studier.
- Forsøk på sanering av husstøvmidd med vanlige tiltak har ikke vist overbevisende effekt på astmasymptomer.
- Jonas maske/buff kan forsøkes om kulde er trigger.
- Opplæring: Det er viktig at foreldre får god opplæring om sykdom og behandling. Astmaskole arrangeres på flere norske sykehus med barneavdeling.
- Komorbiditet: Tilstander som allergisk rhinitt, sinusitt og gastroøsofageal refluks kan forverre astma og bør behandles parallelt.
Farmakologisk behandling
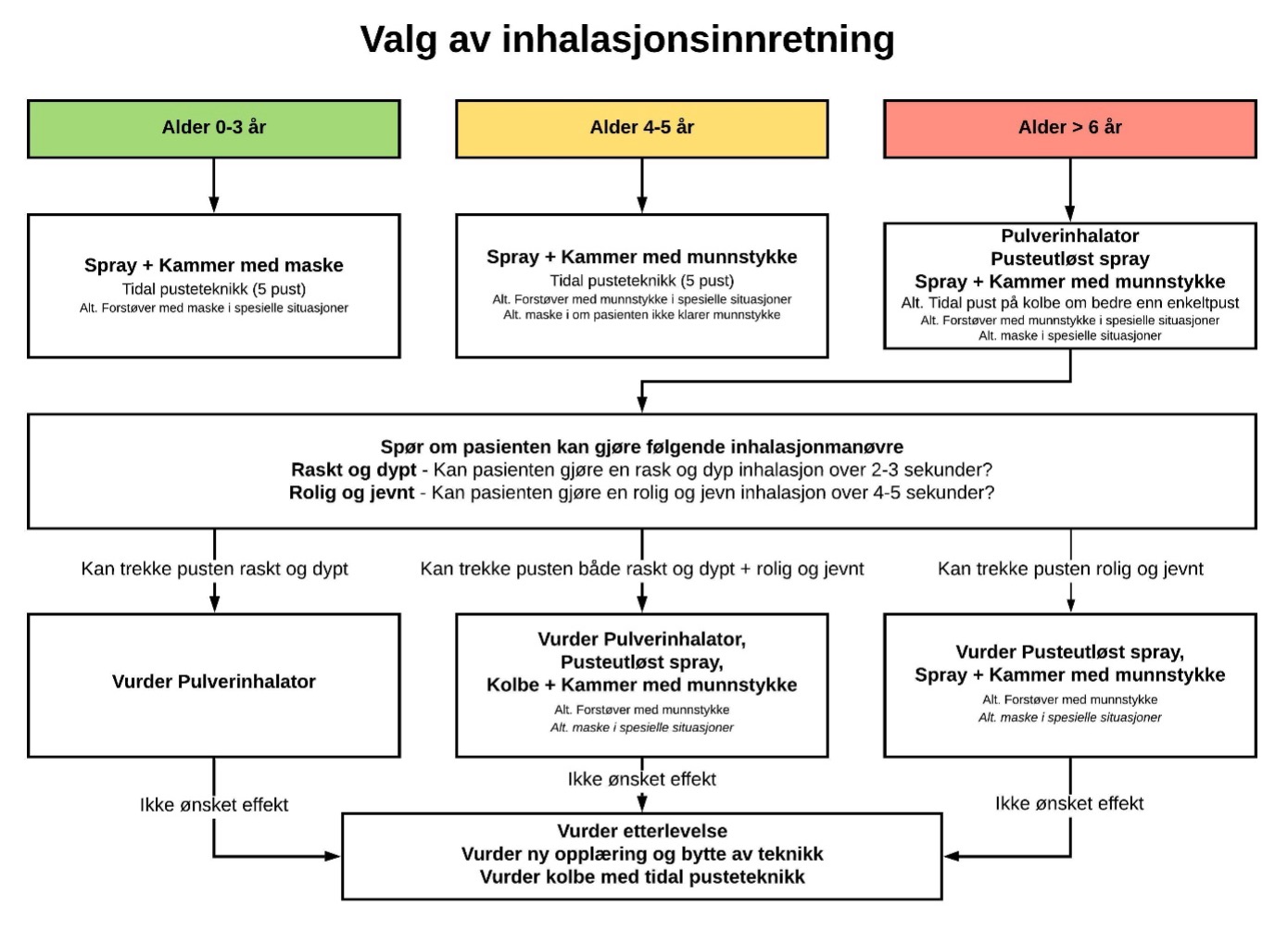
Inhalasjonsmedisiner foretrekkes fordi de gir en høy konsentrasjon av medisin i lungene og minimalt med systemiske bivirkninger. Valg av inhalasjonsinnretning gjøres individuelt basert på tilgjengelige medikamenter, teknikk og pasient/foresattes ønsker (figur 1). Teknikk må læres før oppstart av behandling, og vurderes på alle kontroller, helst ved at pasienten tar med sitt eget utstyr.
Klima- og miljøperspektiv
Inhalatorer med inhalasjonsaerosoler (spray) inneholder drivhusgasser som bidrar til global oppvarming. Ved å bytte fra en spray til en pulverinhalator vil klimagassutslippet reduseres betydelig. Pulverinhalatorer krever imidlertid en koordinert forsert manøver som ikke er mulig for de yngste barna og også kan være vanskelig for mange eldre barn. Inhalasjonsteknikk bør gjennomgås på hver kontroll, og fra 6 års alder kan det være aktuelt å bytte fra spray til pulverinhalator dersom barnet har god nok inhalasjonsteknikk. Det viktigste er at barnet får en optimal behandling. Dersom dårligere astmakontroll etter bytte av inhalator, bør både inhalasjonsteknikk og eventuelt bytte tilbake vurderes.
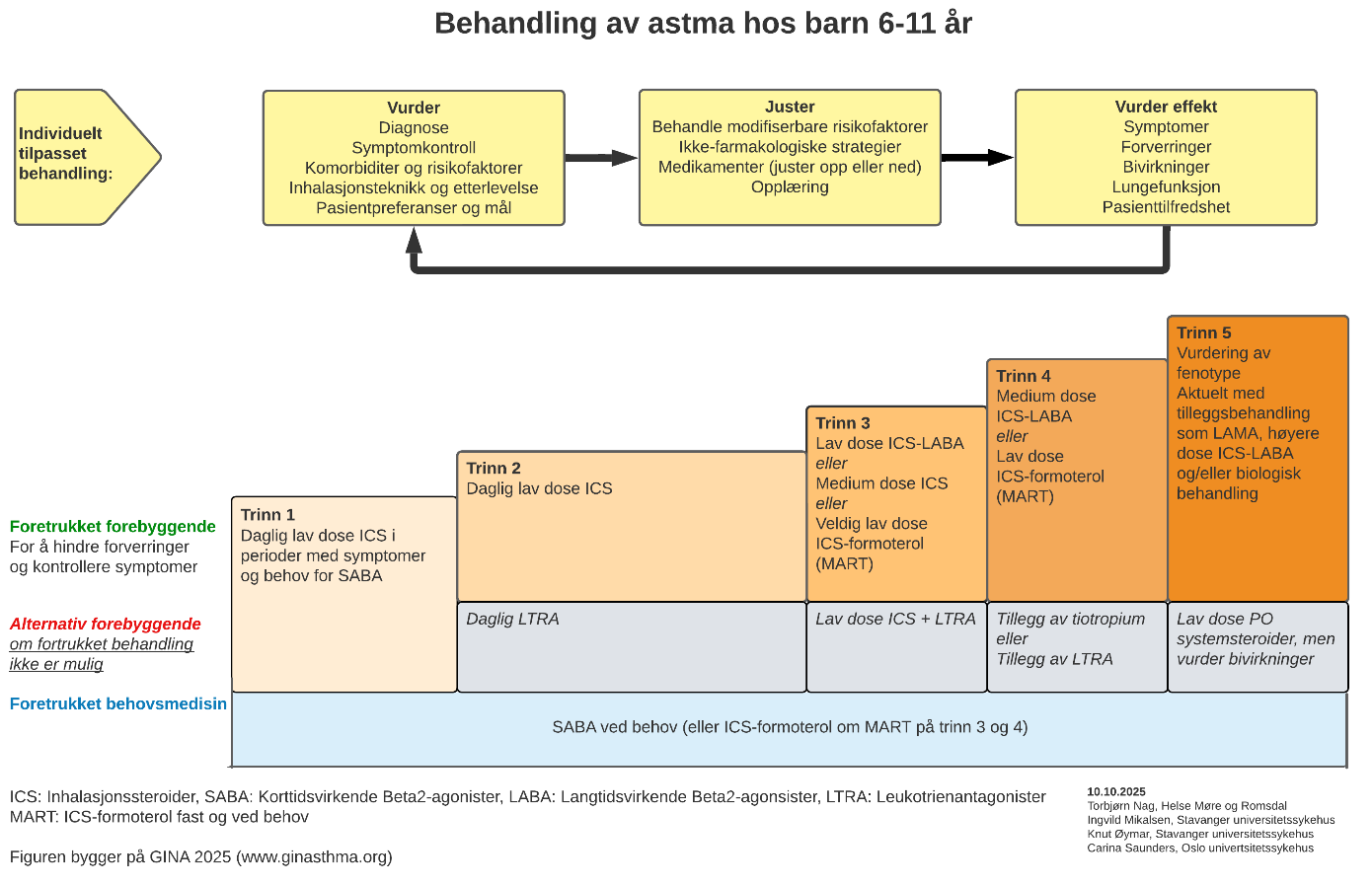
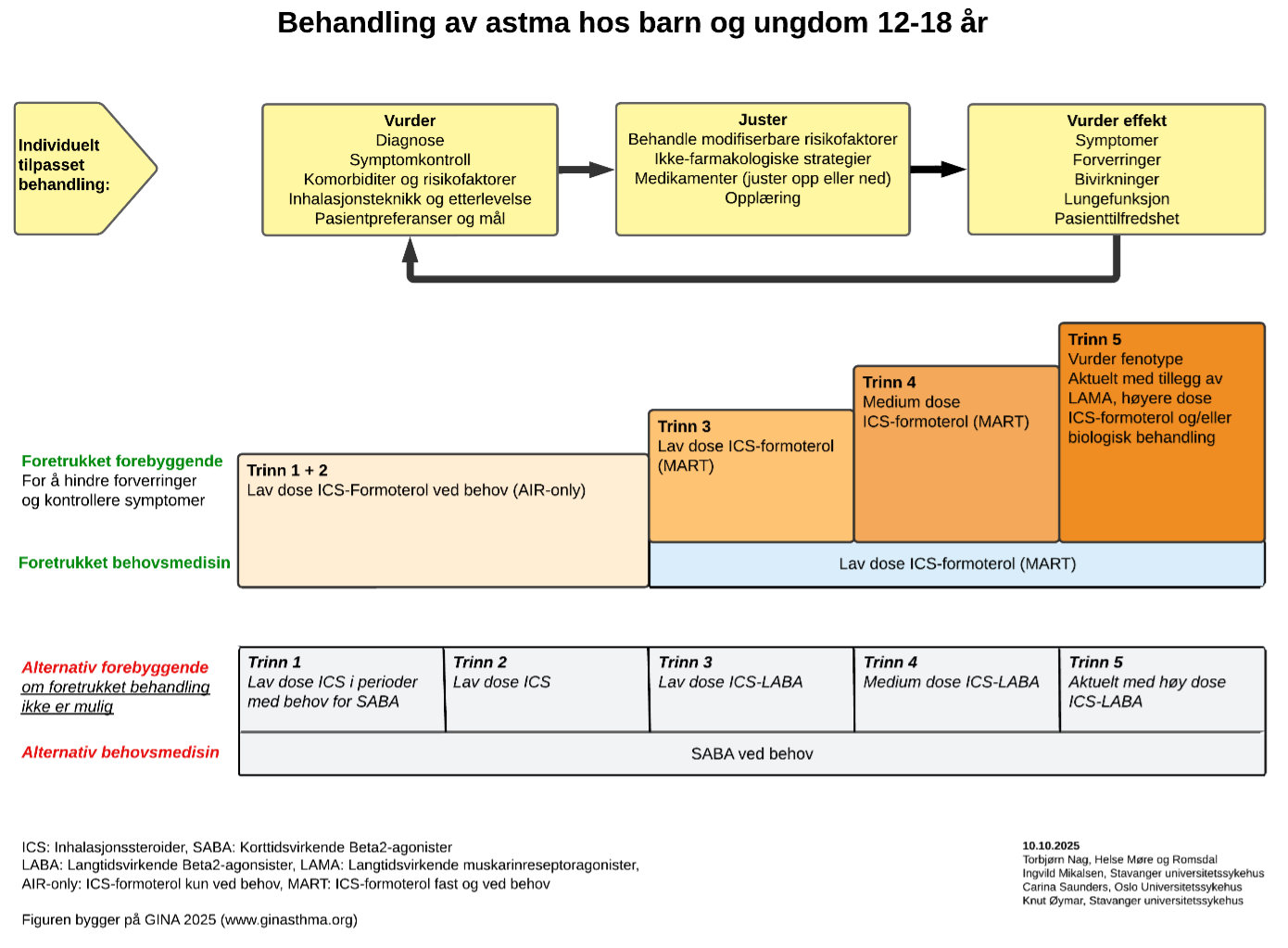
Den farmakologiske behandlingen kommer frem av figur 2 og 3. Figuren viser ulike behandlingsalternativ hvorav den øverste i oransje farge, er den anbefalte behandlingen som i studier har vist best effekt for store grupper. Individuelle faktorer som fenotype, teknikk og egne preferanser kan gjøre at en alternativ behandling bør foretrekkes.
Behandlingen er bygget som en trinnvis prosedyre hvor man trapper opp eller ned avhengig av symptomkontroll og målsettingen er det laveste behandlingstrinnet som gir god symptomkontroll og normal lungefunksjon.
Starttrinn bestemmes ut fra alvorligheten av symptomer og risiko for eksaserbasjoner. Følgende kan brukes veiledende:
- Trinn 1: Sjeldne astmasymptomer < 1–2 x per uke og ingen risikofaktorer for forverring
- Trinn 2: Astmasymptomer < 3–5 dager per uke med normal eller lett redusert lungefunksjon
- Trinn 3: Astmasymptomer de fleste dager i uken, oppvåkning grunnet astmasymptomer ≥ 1 gang per uke eller lav lungefunksjon.
- Trinn 4: Daglige symptomer, nattlig oppvåkning ≥ 1 gang pr uke og redusert lungefunksjon eller nylig eksaserbasjon.
Det anbefales ikke å begynne med høye doser for så å trappe ned. All ny behandling regnes som prøvebehandling. Dersom behandlingen gis riktig og ikke virker, bør den revurderes.
Etter oppstart vil man kunne trappe opp eller ned avhengig av kontroll. Et skåringskjema som vist i tabell 1 vil kunne hjelpe i denne vurderingen. Nedtrapping vurderes ved god kontroll over 3 måneder.
Før opptrapping skal diagnose, respons på behandlingen, etterlevelse, inhalasjonsteknikk og triggerfaktorer alltid vurderes.
Alle barn skal ha en skriftlig astmaplan med oversikt over faste medisiner, der det også fremgår hva de skal gjøre ved forverring av symptomer.
Barn med astma har kronisk inflammasjon i luftveiene med øket risiko for alvorlige forverringer og innleggelser på sykehus. ẞ2-agonister behandler ikke inflammasjon, kan kamuflere symptomer og kan redusere senere effekt av ẞ2-agonister. Det finnes også indikasjoner på at ẞ2-agonister brukt alene kan være proinflammatoriske. Denne effekten ser ut til å forsvinne ved samtidig bruk av inhalasjonssteroider. Det anbefales det derfor å bruke hurtigvirkende β2-agonister sammen med et inhalasjonssteroid, spesielt for barn over 12 år der evidensen er størst, Th2-inflammasjon dominerer, diagnosen er sikrest og sannsynligvis er bivirkningene mindre.
Tabell 2: Dosering av inhalasjonssteroider (doser i mikrogram/døgn)
Obs! Tabellen oppgir ikke ekvivalente doser, men lav, medium og høy dose (μg/døgn) utfra produktinformasjon.
| Inhalasjonssteroid (ICS) | Lav dose | Moderat dose | Høy dose | |
| Barn 6–11 år | Flutikasonpropionat | 50–100 | > 100–200 | > 200 |
| Beclometasone | 50–100 | > 100–200 | > 200 | |
| Ciclesonide | 80 | > 80–160 | > 160 | |
| Budesonid | 100–200 | > 200–400 | > 400 | |
| Barn 12–18 år | Flutikasonpropionat | 100–250 | > 250–500 | > 500 |
| Flutikasonfuroat | 100 200 | |||
| Beclometasone HFA | 100–200 | > 200–400 | > 400 | |
| Ciclesonide | 80–160 | > 160–320 | > 320 | |
| Budesonid | 200–400 | > 400–800 | > 800 | |
Kommentarer medikamenter
SABA (Short acting beta 2 agonist)
Salbutamol doseres vanligvis til 0,2 mg ved behov, men kan justeres etter behov. Ved akutt astma kreves ofte høyere doser (0,4–1,0 mg). Dosering ved behov er minst like effektivt som fast dosering x 4.
ICS (Inhaled corticosteroid)
Se tabell 2 for doseanbefalinger for de ulike produktene.
Dosering av ICS 2 ganger daglig er sannsynligvis marginalt mer effektivt enn 1 gang daglig. Dosering med hele døgndosen x 1 vurderes hos pasienter med godt kontrollert astma eller om de glemmer mange doser. Ciclesonid og flutikasonfuroat (Relvar®) doseres alltid x 1.
Det er ikke vist effekt av dobling av ICS i dårlige perioder/luftveisinfeksjoner hos barn, og dette anbefales ikke rutinemessig (vurderes eventuelt individuelt avhengig av etterlevelse).
De vanligste bivirkningene av ICS er heshet og sopp i munn eller ansikt. Etter inhalasjon med maske bør ansiktet vaskes. Etter alle typer inhalasjoner bør munnen skylles. Heshet vil vanligvis reduseres ved bruk av kolbe. Redusert tilveksthastighet, og i alvorlige tilfeller binyrebarksvikt, er sjeldne bivirkninger. Høyde bør kontrolleres jevnlig, spesielt ved høye doser. Sannsynlig slutthøyde for barn som har brukt ICS over lang tid er ca. 1 cm lavere, men det kan være større utslag for enkeltpasienter. Ved fall i percentilene utredes dette, blant annet med måling av morgenkortisol. Kortisol bør måles rutinemessig hver 6. måned ved bruk av doseekvivalent til flutikasonpropionat ≥ 500 μg/dg eller Beclomethasone ≥ 800 μg/dg. Ved unormal morgenverdi eller kliniske symptomer bør synacthentest vurderes. Ved morgenverdier < 100 bør pasienten diskuteres med endokrinolog med tanke på substitusjonsbehandling. Dersom også andre steroider (nesespray og hudkremer) brukes vurderes dette samlet.
LTRA (Leukotriene-reseptor antagonist)
Brukes i liten grad, men kan være alternativ til barn som ikke klarer å ta inhalasjonssteroider (tar lite medisin/teknikk) eller som tilleggsbehandling. Medikamentet seponeres om manglende effekt. Obs. bivirkninger som søvnproblemer (mareritt) og magesmerter kan sees innimellom.
LABA (long acting beta 2 agonist)
Skal aldri gis uten at barnet får ICS fast, og gis vanligvis som kombinasjonsbehandling med ICS. Formoterol virker like raskt som SABA, og kan brukes både fast x 2 og ved behov, se avsnittet under (MART). Salmeterol brukes fast x 2. Vilanterol brukes fast x 1.
MART (Maintenance and reliever therapy = vedlikehold og symptombehandling)
Ved MART behandling har pasienten bare en inhalator som inneholder en kombinasjon av ICS og formeterol. Denne brukes både som fast behandling og eventuell tilleggsbehandling ved symptomer. Pasienten får da både bronkodilatasjon og en forebyggende antiinflammatorisk behandling (AIR = anti-inflammatory reliever). Studier har vist at MART reduserer behovet for perorale steroider.
I Norge er MART godkjent fra 12 år. Vær oppmerksom på at det er kombinasjon Budesonid/formeterol i styrken 160/4,5 μg som vanligvis brukes ved MART behandling. Anbefalt vedlikeholdsdose budesonid/formeterol (160/4,5 μg) er 1 inhalasjon 1–2 ganger daglig. For enkelte pasienter kan en vedlikeholdsdose på 2 inhalasjoner 2 ganger daglig være nødvendig, eventuelt i perioder. Ved symptomer kan pasienten ta 1 tilleggsinhalasjon ved behov som kan gjentas. Det er vanligvis ikke nødvendig med mer enn 8 inhalasjoner daglig. Det kan likevel brukes inntil 12 inhalasjoner (total dose = vedlikehold og symptombehandling) daglig i en begrenset periode. Pasienter som bruker > 8 inhalasjoner daglig bør sterkt rådes til å ta kontakt med lege.
GINA anbefaler MART behandling også i aldersgruppen 6–11 år, men MART er mindre dokumentert hos yngre barn. ICS-formeterol brukt som symptombehandling forutsetter at pasienten også bruker ICS-formeterol som vedlikeholdsbehandling. I denne aldersgruppen er budesonid/formeterol 80/4,5 μg mest aktuelt.
Tabell 3 kan brukes som veiledning ved opptrapping og nedtrapping av MART behandling og er noe omskrevet fra Box 4-8 i GINA Guidelines 2024.
Tabell 3: Veiledende dosering ved MART behandling
| Alder | Inhalator-mikrogram avgitt dose | Dosering ut fra alder og behandlingstrinn | |
| 6–11 år | Budesonid-formeterol 80/4,5 mikrogram Maks 8 inhalasjoner pr dag. Pasienten bør oppsøke lege hvis hen nærmer seg maks antall inhalasjoner pr dag. | Trinn 1–2 | Ingen dokumentasjon for AIR only i denne aldersgruppen |
| Trinn 3 | 1 inhalasjon fast 1 gang daglig og 1 inhalasjon ved behov | ||
| Trinn 4 | 1 inhalasjon fast 2 ganger daglig og 1 inhalasjon ved behov | ||
| Trinn 5 | MART ikke anbefalt | ||
| 12–18 år | Budesonid-formeterol 160/4,5 mikrogram Maks 12 inhalasjoner pr dag, men ved > 8 inhalasjoner pr dag bør pasienten oppsøke lege. | Trinn 1–2 | Kun ved behov (AIR only) 1 inhalasjon ved behov |
| Trinn 3 | 1 inhalasjon fast 1–2 ganger daglig og 1 inhalasjon ved behov | ||
| Trinn 4 | 2 inhalasjoner fast 2 ganger daglig og 1 inhalasjon ved behov | ||
| Trinn 5 | 2 inhalasjoner fast 2 ganger daglig og 1 inhalasjon ved behov | ||
| AIR: Anti inflammatory reliever | |||
Når man ikke kommer til mål
Dersom man ikke oppnår ønsket effekt av behandling, må det alltid vurderes om pasienten tar medisinen på riktig måte, med hyppighet og dose som forskrevet og om diagnosen er riktig.
Inhalasjonsteknikk må kontrolleres på alle kontroller, fortrinnsvis ved at pasienten tar med sitt eget utstyr. Ved forverring eller manglende effekt av behandling bør det vurderes å bytte inhalasjonsinnretning. Vær oppmerksom på at det i Norge er generisk bytte også på legemidler til inhalasjon, og dette innebærer at pasienter kan få utlevert innretninger de ikke er kjent med. Ved behov kan resepten «låses» for generisk bytte.
Minst 50 % av pasienter med astma tar ikke medisinene som forskrevet, i alle fall store deler av tiden. Dette er sannsynligvis den viktigste årsaken til dårlig astmakontroll, og må vurderes på hver kontroll. Ofte kan man stille et empatisk spørsmål der man anerkjenner at mange ofte glemmer for å få i gang en diskusjon.
«Mange pasienter bruker ikke inhalasjonsmedisinene sine som avtalt. Hvor mange ganger i løpet av siste uke har du tatt medisinen din - 1, 2, 3, 4 eller flere»
«Synes du det er lettere å huske medisiner på morgenen eller kvelden?»
Dersom man avdekker dårlig etterlevelse, må dette tas tak i. Hør på hva pasient/foreldre tenker. Noen ganger har de spesielle preferanser på inhalasjonsinnretning. Noen ganger kan endring i inhalasjonsregime til 1 gang daglig hjelpe (f.eks. flutikasonfuroat/vilanterol kombinasjon (Relvar Ellipta®)). MART/AIR (1 inhalator, eventuelt kun ved behov) kan også være fordelaktig hos noen.
Vurder behov for annen utredning hos pasienter som ikke responderer som forventet på behandling som tas på en tilfredsstillende måte (gjerne i samråd med subspesialist).
Behandling på trinn 5 bør være i samråd med subspesialist. Langtidsvirkende muskarinreseptorantagonister (LAMA) kan være effektivt hos noen pasienter.
Biologisk behandling kan være aktuelt som tilleggsbehandling hos astmapasienter som på tross av god etterlevelse ikke har god nok astmakontroll. Planen er at dette vil bli beskrevet i et eget kapittel i generell veileder.
Nedtrapping
For å vurdere bedring, hindre overbehandling og redusere bivirkninger bør nedtrapping av fast behandling vurderes hos barn som har vært godt kontrollert i 3 måneder. Nedtrapping og seponering vurderes når diagnosen eller effekt av behandling er usikker.
Ved nedtrapping av inhalasjonssteroider reduseres dosen med ca. 50 % hver 3. måned inntil lav dose (se tabell 2). Hos barn som er godt kontrollert på lav dose kan medikamentet vurderes seponert etter ytterligere 3 måneder. Ved sannsynlig atopisk astma/eosinofil inflammasjon kan ofte laveste dose forebyggende behandling som gir god kontroll beholdes over lengre tid, avhengig av tidligere sykehistorie. Ved seponering av forebyggende behandling er god oppfølging i tiden etterpå viktig.
Hos barn med pollenallergi som bare har astmasymptomer i pollensesongen, kan fast forebyggende behandling med ICS startes noen uker før pollensesongen og avsluttes når den er over. Resten av året kan barnet behandles på trinn 1. Hos barn der symptomene først og fremst utløses av infeksjoner kan nedtrapping i sommerperioden vurderes. Ved residiv av symptomer startes behandlingen opp igjen i samråd med lege.
Kontroller
Barn med godt kontrollert astma og fast behandling bør kontrolleres minst hver 6. måned. Barn med dårlig kontrollert astma, eller der man gjør endringer av behandling, bør kontrolleres hyppigere etter individuell vurdering. Barn som er godt kontrollert og kun bruker medisiner ved behov/i perioder, bør kontrolleres minst årlig. Omsorgsnivå må vurderes individuelt ut fra astmakontroll, sikkerhet av diagnose, fastlegens kompetanse, grad av astma etc. Vanligvis vil pasienter på behandlingsnivå 3–4 eller ved usikkerhet om diagnosen følges i spesialisthelsetjenesten.
Viktige elementer ved kontroller er:
- Astmakontroll (ev. med astmakontroll skåringskjema)
- Revurdering av diagnose
- Gjennomgang og justering av behandlingsskjema
- Vurdering av inhalasjonsteknikk og etterlevelse
- Lengde (og vekt), spesielt av barn som får ICS (se over)
Trygderettigheter
Foreldre til barn som har økt fravær fra skole grunnet astma, kan søke om utvidet antall dager omsorgspenger. Lege fyller ut legeerklæring. I noen tilfeller der barnet har behov for mye oppfølging, kan foreldrene søke om hjelpestønad. Dette vurderes individuelt.
Figur 1: Valg av inhalasjonsinnretning
Figur 2: Behandling av astma hos barn 6–11 år
(MART behandling og doser er også beskrevet i tabell 3)
Figur 3: Behandling av astma hos barn og ungdom 12–18 år
(MART behandling og doser er også beskrevet i tabell 3)
Tidligere versjoner
Publisert 2006: Gisle Rød, Knut Øymar og Britt Skadberg
Revidert 2009: Gisle Rød, Knut Øymar og Britt Skadberg
Revidert 2020: Torbjørn Nag, Camilla Andrea Moen, Suzanne Crowley, Ingvild Mikalsen og Knut Øymar
Referanser og litteratur
- FHI - Astma og allergi https://www.fhi.no/nettpub/hin/ikke-smittsomme/astma-allergi/
- Global initiative for asthma (GINA) guidelines 2025 https://ginasthma.org/
- UpToDate - asthma in children younger than 12 years of age
- Dharmage SC, et. al. Epidemiology of asthma in children and adults, Front Pediatr. 2019; 7:246.
Ved tilbakemeldinger eller spørsmål, send en mail til veiledere@barnelegeforeningen.no.










