Nyfødtveileder
18 Smertebehandling, sedering og palliasjon
18.1 Smerte og smertebehandling
Sist faglig oppdatert: 06.02.2025
Jannicke H. Andresen og Claus Klingenberg
«Veileder for forebygging, vurdering og behandling av smerte hos nyfødte», utarbeidet av en nasjonal tverrfaglig gruppe oppnevnt av Interessegruppen i Nyfødtmedisin, ble publisert på ‘Legemidler til barn’ sine nettsider i 2023. For utfyllende informasjon om alle aspekter av smerte, og dets forebygging, vurdering og behandling henvises til denne veilederen.
Nyfødtveilederen er tenkt å være et sted for å kunne slå opp raskt, og er derfor ikke like utfyllende - men inneholder alle doseringer fra smerteveilederen (utenom Gabapentin).
Bakgrunn
Smerte: Ubehagelig sensorisk og emosjonell opplevelse assosiert til en reell eller potensiell vevsskade.
Premature og syke nyfødte barn som er innlagt på sykehus blir daglig eksponert for stress og smerte ved prosedyrer. I tillegg opplever de pågående stress/smerte grunnet CPAP, infusjoner, sondeernæring osv. Repetert stress og smerte fører til dårligere vekst, forsinket kognitiv og motorisk utvikling, og endret hormonell respons. På bakgrunn av dette bør antall smertefulle prosedyrer på syke nyfødte og premature barn holdes så lavt som mulig og barna må systematisk observeres, og behandles for prosedyrerelatert og pågående smerte.
Klinikk og symptomer
Atferds- og stressreaksjoner som tegn på smerte hos premature og syke nyfødte:
- Karakteristiske ansiktsuttrykk som reaksjon på smertestimuli sees fra 25 ukers alder, men blir lettere å tolke/tydeligere hos mer modne barn: øyebrynene er senket, øyne er knepet igjen, dyp nasolabial fure, åpen munn og stram, ikke-protruderende tunge.
- Gråt: Umodne premature barn kan lage gråteansikt og gråte med sped stemme fra uke 24. De minste barnas evne til hørbar gråt er imidlertid begrenset; fravær av gråt betyr således ikke fravær av smerte.
- Ansikts- og kroppstonus regnes som et valid tegn på stress og smerte. Barnet kan for eksempel reagere med anstrengt eller uttrykksløst ansikt og lav eller høy kroppstonus.
- Fysiologiske parameter: O2-forbruk, puls og BT øker, økt tendens til pulmonal hypertensjon. I blodet stiger nivå av «stresshormoner» - kan gi økt frisetting av glukose og laktat.
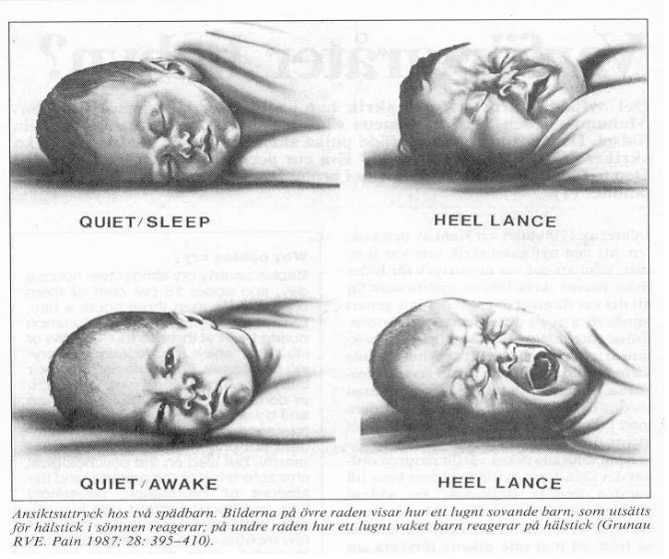
Diagnostikk og utredning
Det er vanskelig å objektivt måle smerte hos nyfødte, samt å skille smerte fra stress. Internasjonalt omtales smerte som den femte vitale parameteren, og man anbefaler at smerte evalueres og dokumenteres systematisk på lik linje som puls, SpO2, blodtrykk og kroppstemperatur.
Bruk av validerte skåringsverktøy, oppdaterte smerteprosedyrer og et godt samarbeid mellom sykepleier og lege er viktig for å få riktig tiltak ved smerte og stress. Det finnes en rekke smerteskåringsverktøy som er utviklet for premature og syke nyfødte. Alle avdelinger som behandler barn og nyfødte bør ha skåringsverktøy for den aktuelle pasientgruppen, og implementere dette i sin daglige håndtering av barna.
Fysiologiske parameter er nyttig i vurdering av akutt eller prosedyrerelatert smerte.
Forebygging, behandling og oppfølging
Redusere pågående smerte og stress: Foreldrekontakt, redusere ytre stimuli, unngå å vekke sovende barn.
Redusere prosedyrerelatert smerte og stress: Redusere antall prosedyrer.
Ikke-farmakologiske behandlingstiltak mot smerte
Planlegg alle intervensjoner (NIDCAP) - optimaliser omsorgsituasjonen
- Tilrettelegge for beskyttet søvn, unngå å forstyrre barnet mens det er i dyp søvn.
- Barnet bør om mulig være mett og ha hvilt minimum 30 min i forkant av prosedyren.
- Støtt barnet under smertefulle prosedyrer. Bruk foreldrene som aktive deltagere om mulig.
- Hjelp barnet til å samle seg og være i balanse ved god støtte av tøybleie/rede.
- Ev. kangaroo care (holdes tett inntil foreldre).
- Suging på smokk. Non-nutritiv suging virker smertelindrende spesielt i kombinasjon med morsmelk, men mindre enn med sukkervann.
- Amming er like effektivt som glukose + smokk.
- Reduser annen negativ sensorisk stimulering under prosedyren: lyd, lys i ansiktet etc.
Farmakologiske behandlingstiltak
Sukkervann/sukrose
25–30 % sukrose er hos nyfødte vist å redusere skriking, dempe smerteuttrykk og fysiologiske smerteresponser ved prosedyrer. Sukkeret påvirker smaksreseptorer og gir en følelse av velbehag samtidig som kroppens opioidreseptorer påvirkes.
Praktisk gjennomføring: Drypp sukrose, dråpe etter dråpe, på tungespissen og la deretter barnet suge på smokk. Sukrose har best effekt hvis det gis ca. 2 minutter før prosedyren, og effekten varer ca. 5–7 min. Dosen kan gjentas til maks dose (se tabell 1). Sukrose er en medisin og bør brukes til å redusere prosedyrerelatert smerte, ikke til å roe barnet.
Tabell 1: Dosering sukrose
| Postmenstruell alder (PMA) | Første dose (ml) | Maks dose (ml) per prosedyre |
| 24–26 | 0,1 | 0,5 |
| 27–31 | 0,25 | 1 |
| 32–36 | 0,5 | 2 |
| 37–44 | 1 | 1 ml/kg/dag |
| 45–60 | 2 | 1 ml/kg/dag |
Lokalbedøvelse
EMLA-krem
Inneholder lidokain og prilokain. Ikke dokumentert trygt for premature < 30 uker. Kan brukes x 1 per døgn, helst ikke repetert bruk første leveuke.
Indikasjoner: Anleggelse av arteriekran, elektiv spinalpunksjon, hudbiopsi, vaksine etc.
NB. har ikke dokumentert effekt ved hælstikk.
Tabell 2: EMLA-krem
| Alder | Dosering | Maksimum dose | Applikasjonstid | Virketid etter kremen er tatt bort |
| GA 30–37 uker | 0,5 g | 0,5 g/24 timer | 1 time | 1–2 timer |
| GA 37 uker–3 md. | 0,5–1 g | 0,5 g/12 timer | 1 time | 1–2 timer |
Lokalanestesi for prosedyre i nese og svelg
Lidokain injeksjonsvæske kan brukes for lokalanestesi ved sondenedleggelse eller laryngoskopi. Kan også brukes for andre prosedyrer i regi av ØNH.
Dosering under 6 måneder: Lidokain injeksjonsvæske 2,5 mg/kg.
For administrasjon brukes device (MAD-nasal, MADgic) - husk dødvolum.
Tabell 3: Dosering av lidokain injeksjonsvæske 10 mg/ml i forhold til vekt ved lokal anestesi av nese og svelg. Dosen (sum av dose i ett nesebor og dose i svelg) tilsvarer 2,5 mg/kg.
| Pasientens vekt | TOTALVOLUM til pasienten Trekk opp hhv. 0,1 eller 0,2 ml i tillegg pga. dødvolum i device | VOLUM i ett nesebor | VOLUM i svelg |
| 1 kg | 0,24 ml | 0,12 ml | 0,12 ml |
| 2 kg | 0,5 ml | 0,25 ml | 0,25 ml |
| 3 kg | 0,75 ml | 0,38 ml | 0,38 ml |
| 4 kg | 1 ml | 0,5 ml | 0,5 ml |
| 5 kg | 1,25 ml | 0,63 ml | 0,63 ml |
| 6 kg | 1,50 ml | 0,75 ml | 0,75 ml |
| 7 kg | 1,75 ml | 0,88 ml | 0,88 ml |
Lidokain gel 2,5 % (20 mg/ml)
Indisert ved blærekateterisering. Påføres ved urethralåpning, vent 5 minutter for full effekt.
Obs. dose, maks 5 mg/kg (0,25 ml/kg), 4 mg/kg hos premature.
Infiltrasjonsanestesi (Lidokain 10 mg/ml uten adrenalintilsetning)
Indikasjon: Anleggelse av thoraxdren, mindre kirurgiske inngrep (biopsier) etc.
Dosering 2–4 mg/kg s.c.
NB. maksimal dose: 5 mg/kg, 4 mg/kg hos premature. Husk anslagstid 1–2 minutter.
Paracetamol
Brukes til behandling av mild-moderat pågående smerte. Ved postoperativ smerte skal paracetamol (p.o./i.v.) brukes som basis-smertebehandling sammen med opioider (reduserer behovet for opioider). Paracetamol er ikke indisert for behandling av akutt og prosedyrerelatert smerte.
Den nyfødtes lever er pga. umodne enzymsystemer relativt beskyttet mot paracetamoltoksisitet. Halveringstiden av paracetamol i plasma er lengre hos nyfødte enn hos eldre barn.
Rektal absorpsjon har stor interindividuell variabilitet hos nyfødte, og derfor bør p.o. administrasjon foretrekkes, men rektal administrasjon kan brukes på barselavd. og ved ventrikkelretensjon.
PO = peroral, IV = intravenøs
Tabell 4: Dosering paracetamol.
| Paracetamol | Aktuell alder (uke+dager) | Metningsdose (mg/kg) | Vedlikeholdsdose (mg/kg x doser per dag) | Døgndose (mg/kg/d) |
PO | < 28 | - | 10 x 3 | 30 |
| 28–32+6 | - | 10 x 3 | 30 | |
| 33–37 | - | 15 x 3 | 45 | |
| Termin | - | 15 x 4 | 60 | |
IV | < 32 | 12 | 6 x 4 | 24 |
| 32–44 | 20 | 10 x 4 | 40 | |
| Over 1 måned | 20 | 15 x 4 | 60 | |
REKTALT | 28–31+6 | 20 | 20 x 2 | 40 |
| 32–35+6 | 30 | 20 x 2 | 40 | |
| 36–44 | 30 | 20 x 3 | 60 | |
| Over 1 måned | 40 | 30 x 3 | 90 |
Doser er fra Koble. Obs. behandling av pågående smerte betyr fast smertelindring, ikke ved behov (gjelder for paracetamol og opioider).
Opioider
Obs. Tabellene under differensierer mellom selvpustende og intubert pasient - pasienten skal ha adekvat smertelindring. Hvis det medfører respirasjonsdemping skal pasienten intuberes, ikke smertelindring holdes tilbake. All behandling med opioider titreres til effekt, dvs. begynn med lav dose og gjenta til effekt. De to vanligste opioider brukt hos nyfødte er morfin og fentanyl.
Morfin er godt egnet for behandling av pågående smerte. Morfin har lenger halveringstid (6–10 timer for terminfødte, 10–18 timer hos premature) og er mer sedativt enn Fentanyl - noe som ofte er hensiktsmessig. Morfin har for langsom anslagstid til at den er godt egnet som smertebehandling ved prosedyrer.
Tabell 5: Morfin til selvpustende barn med prolongert smerte
| Alder (PMA) | Første dose (μg/kg) | Fast dose/vedlikeholdsdose (μg/kg) | Antall doser per dag | |
| PO | ≥ 37 | 50–100 | 50–100 | 6 |
| < 37* | 25–50 | 25–50 | 4–6 | |
| Intermitterende IV administrasjon | ≥ 37 | 50 | 50 | 6 |
| < 37 | 25–50 | 25–50 | 4–6 | |
| Alder (PMA) | Første dose (μg/kg) | Infusjon (μg/kg/t) | ||
| Kontinuerlig IV administrasjon | ≥ 37 | 50 | 5–10 (maks 20) | |
| < 37 | 25–50 | 3–5 (maks 10) | ||
*Husk fare for akkumulering hos premature pga. lang halveringstid.
Tabell 6: Morfin til intuberte barn med pågående smerte
| Alder (PMA) | Første dose (μg/kg) | Fast dose/vedlikeholdsdose (μg/kg) | Antall doser per dag | |
| Intermitterende IV administrasjon | ≥ 37 | 100–200 | 100–200 | 6 |
| < 37 | 50–100 | 50–100 | 4–6 | |
| Alder (PMA) | Første dose (μg/kg) | Infusjonshastighet (μg/kg/t) | ||
| Kontinuerlig IV administrasjon | ≥ 37 | 100 | 5–20 (50*) | |
| < 37 | 50–100 | 3–20 | ||
*Når morfin gis som kontinuerlig infusjon kan det være nødvendig å starte med en eller flere bolusdoser («loading dose») for å komme opp i adekvat analgetisk serumkonsentrasjon. F.eks. 50–100 mikrogram/kg i.v. over 30–60 minutter.
Fentanyl er et syntetisk opioid som er 50–100x mer potent enn morfin. Det har raskere anslagstid (maks effekt etter 4 min), kortere halveringstid (5 timer hos terminfødte, 6–32 timer hos premature) og gir mindre sirkulasjonsdepresjon enn morfin og er derfor meget godt egnet hos syke, sirkulatorisk ustabile nyfødte (f.eks. med PPHN) og forut for smertefulle prosedyrer slik som intubasjon, thoraksdren, spinalpunksjon og som analgesi ved operasjoner.
Tabell 7: Fentanyl til selvpustende og intuberte nyfødte
| Alder (PMA) | Første dose (μg/kg) | Fast dose/vedlikeholdsdose (μg/kg) | Antall doser per dag | |
| Intermitterende IV administrasjon | ≥ 37 | 0,5–3 | Ikke aktuelt | |
| < 37 | 0,3–1 | |||
| Alder (PMA) | Første dose (μg/kg) | Infusjon (μg/kg/t) | Bolus (μg/kg) | |
| Kontinuerlig IV administrasjon | ≥ 37 | 0,5–3 | 0,5–3 | 0,5–3 |
| 28–36 | 0,5–1 | 0,5–1 | 0,5–1 | |
| 23–27* | 0,5–1 | 0,3–0,5 | 0,3–0,5 | |
*De første 10 levedøgnene i gruppen PMA 23–27 uker er halveringstiden så lang at bolus doser er å foretrekke framfor kontinuerlig infusjon.
Lavdose naloxon (Narcanti®) kan gis for å forhindre enterale bivirkninger til opioidbehandling (obstipasjon). Anbefalt dose for fullbårne og premature er Naloxone hydroklorid mikstur 10 mikrogram/ml (spesiallaget fra Apotek); 3 mikrogram/kg x 4 p.o. Dosen økes ved behov, vær klar over at store doser kan tas opp systemisk og kan gi abstinenser. Hos barn > 1 md. alder brukes 3–12 mikrogram/kg x 4.
Klonidin (Catapresan®)
Klonidin er en sentral alfa-2 agonist. Virker mildt sederende og smertelindrende, og kan øke effekten av andre analgetika. Indikasjoner for Klonidin:
- Smerte/uro: Som tillegg til annen smertebehandling/sedasjon. Opioidsparende. Dosering:
- IV: Intermitterende 0,5–2 mikrogram/kg over 10–15 minutter x 4–6
Kontinuerlig: metningsdose 1 mikrogram/kg uansett GA Vedlikehold: ≤ 28 uker 0,1–0,5 mikrogram/kg/t
> 28 uker 0,1–1 mikrogram/kg/t
Terminbarn 0,1–1 (2) mikrogram/kg/t - PO: 1–4 mikrogram/kg x 4(–6)
- IV: Intermitterende 0,5–2 mikrogram/kg over 10–15 minutter x 4–6
Deksmedetomidine (Dexdor®)
Deksmedetomidin er anxiolytisk, sederende og mildt analgetisk, det har opioidsparende effekter. Derfor et godt medikament som tilleggsbehandling ved opioider som smertelindring. Deksmedetomidin gis nasalt som sedasjon ved prosedyrer - dette har liten analgetisk effekt og bør kombineres med analgetika ved smertefulle prosedyrer.
Dosering kontinuerlig IV:
0,2–1,5 mikrogram/kg/t i.v.
Viktig med nedtrapping før seponering, max 0,1–0,2 mikrogram/kg/t hver time. Dette for å unngå rebound effekt og abstinenser som kan oppstå ved brå seponering (etter 48 timers bruk). Symptomer på abstinenser er takykardi, hypertensjon og agiterthet. Maks. dose ved kjøling antas å være 1,0 mikrogram/kg/t uten at det her foreligger tilstrekkelig evidens.
Ketamin
Ketamin er en NMDA-reseptor antagonist. Ketamin er et anestetika som gir en dissosiativ anestesi (dvs. en kataton tilstand med analgesi og amnesi, men ikke alltid med tap av bevissthet, derfor med potensielt psykomimetiske bi-effekter som for eksempel mareritt og hallusinasjoner). Det virker analgetisk, og i høyere doser sedativt. Ingen effekt på respirasjon. Det er særlig nyttig hos hemodynamisk ustabile pasienter, spesielt der man ønsker å unngå og måtte gi respirasjonsstøtte/intubasjon. Ketamin gir lett økning av både hjertefrekvens og blodtrykk. For å forebygge CNS bivirkninger kan ketamin med fordel kombineres med α2-mimetika (klonidin og deksmedetomidin) eller propofol. Midazolam har tidligere blitt brukt til dette - men dette anbefales ikke (Midazolam gir også dissosiativ anestesi).
Ketamin er i dyreforsøk vist å være nevrotoksisk, og anbefales derfor ikke til premature, og brukes med forsiktighet til alle nyfødte. Fortrinnsvis av personale med erfaring med medikamentet. Ketamin er et potent smertelindrende medikament i lave doser. Synergistisk effekt med opioider.
Anbefalt dose ketamin for analgesi i den neonatale populasjonen (GA ≥ 40 uker):
- Bolus i.v. 0,25–0,5 mg/kg
- Bolus nasalt 0,5–1,5 mg/kg
- Bruk MAD nasal eller annen nasal forstøver, små volum (helst 0,1 ml per nesebor), obs. dødvolum i device, se deksmedetomidin nasal administrasjon
- Kontinuerlig i.v. 0,02–0,1 mg/kg/t
I.v. bolus gis over 1 minutt, effekt etter 1–2 minutter, varighet 5–15 minutter.
Referanser
- McPherson C, et al. Practical approaches to sedation and analgesia in the newborn. Journal of perinatology 2020; 1-13.
- Ohlsson A, et al. Paracetamol (acetaminophen) for prevention or treatment of pain in newborns. Cochrane Database Syst Rev. 2020; 1(1):Cd011219.
- Roofthooft DWE, et al. Randomized Controlled Trial Comparing Different Single Doses of Intravenous Paracetamol for Placement of Peripherally Inserted Central Catheters in Preterm Infants. Neonatology. 2017; 112(2):150-8.
- Shahid S, et al. Efficacy and Safety of EMLA Cream for Pain Control Due to Venipuncture in Infants: A Meta-analysis. Pediatrics. 2019; 143(1).
- Mort DO, et al. Does topical local anaesthesia reduce the pain and distress of nasogastric tube insertion in children? Arch Dis Child. 2020; 105:697-700.
- Dontukurthy S, et al. Update on Local Anesthetic Toxicity, Prevention and Treatment During Regional Anesthesia in Infants and Children. The journal of pediatric pharmacology and therapeutics: JPPT: the official journal of PPAG. 2021; 26(5):445-54.
- Yan J, et al. Dual effects of ketamine: neurotoxicity versus neuroprotection in anesthesia for the developing brain. Journal of neurosurgical anesthesiology. 2014; 26(2):155-60.
- Zhao Y, et al. Mechanisms of Dexmedetomidine in Neuropathic Pain. Front Neurosci. 2020; 14:330.
- Anand KJ. Prevention and treatment of neonatal pain. Up to date. 2021.
- Akkawi R, et al. Effect of oral naloxone hydrochloride on gastrointestinal transit in premature infants treated with morphine. Acta Paediatr. 2009; 98(3):442-7.
- Völler S, et al. Rapidly maturing fentanyl clearance in preterm neonates. Arch Dis Child Fetal Neonatal Ed. 2019; 104:F598-603.
- Sperotto F, et al. Ketamine Prolonged Infusions in the Pediatric Intensive Care Unit: a Tertiary-Care Single-Center Analysis. The journal of pediatric pharmacology and therapeutics: JPPT: the official journal of PPAG. 2021; 26(1):73-80.
- Kamp J, et al. Ketamine Pharmacokinetics. Anesthesiology. 2020; 133:1192-1213.










