Nyfødtveileder
5 Lunge og respirasjon
5.17 Konvensjonell respiratorbehandling
Sist faglig oppdatert: 28.06.2022
Claus Klingenberg, Per Ivar Kaaresen, Anne Lee Solevåg, Kristina Wendel, Ingrid B. Nissen, Jannicke H. Andresen, Atle Moen og Hans Jørgen Guthe
Vanlige forkortelser brukt ved respiratorbehandling
Terminologien og forkortelser brukt ved respiratorbehandling hos nyfødte kan være svært forvirrende. Ulike respiratorer kan ha ulike betegnelser på samme innstillinger.
Vi presenterer her kort noen vanlige og hyppig brukte forkortelser:
Innstillinger
PIP – positive inflation (inspiratory) pressure – topptrykk
PEEP – positive end-expiratory pressure – trykk mellom to pust (CPAP-trykk)
Ti – inflasjonstid/inspirasjonstid
Te – ekspirasjonstid
Flow eller rising time – stigetid – hvor rask trykket øker fra PEEP til PIP
VT – tidalvolum
MV – minuttvolum
Bakgrunn
Her beskrives hovedsakelig strategier for respiratorbehandling av premature med RDS.
Strategien må modifiseres ved andre sykdomstilstander (se under respektive kapitler). Spesielt viktig er at de foreslåtte innstillingene ikke gjelder hos lungefriske som respiratorbehandles av andre årsaker (for eksempel postoperativt).
Presentasjonen av ulike respirator-modi gjelder likevel generelt.
Samtidig som respiratorbehandling er livreddende for premature kan den i seg selv gjøre skade (også kalt VILI – ventilator induced lung injury) og være en medvirkende årsak til utvikling av BPD. Respiratorbehandling kan skade lungene og ev. indirekte andre organer via følgende mekanismer:
- Atelektotraume: De små luftveier har en tendens til å kollapse, særlig ved RDS med surfaktantmangel hos premature. Sykliske kollaps/åpning av små luftveier induserer lungeskade og frisetting av cytokiner (også kalt Biotraume) som kan påvirke andre organer.
- Volutraume: Overdistensjon av luftveiene, særlig umodne alveoler pga. for store tidalvolum, skader lungene.
- Atelektotraume + volutraume: En synergistisk negativ effekt av atelektotraume og volutraume; dvs. kombinasjonen av syklisk kollaps og overstrekking av luftveiene er spesielt skadelig
- Oksygen: Høy FiO2 (spesielt > 0,6) er toksisk for lungene via bl.a. frie radikaler. Det er også data som tyder på at SpO2 > 95 % hos barn som får oksygentilskudd er skadelig for lungene.
For å unngå VILI må en derfor både unngå kollaps og overdistensjon av lungene. Hovedstrategien er å «åpne opp lungene», holde dem åpne og unngå overdistensjon. Dette vil også minimere O2-behovet.
Figuren under illustrerer high/low volume injury zones og at spesielt premature er utsatt for begge pga. små lungevolum i denne pasientgruppen.
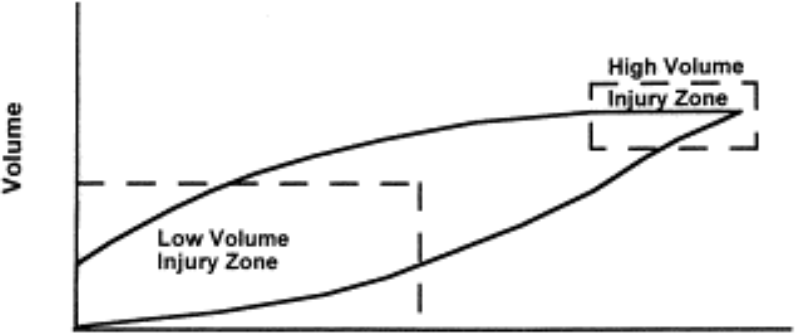
This frame shows a pressure -volume curve and indicates the low volume and high volume injury zone.
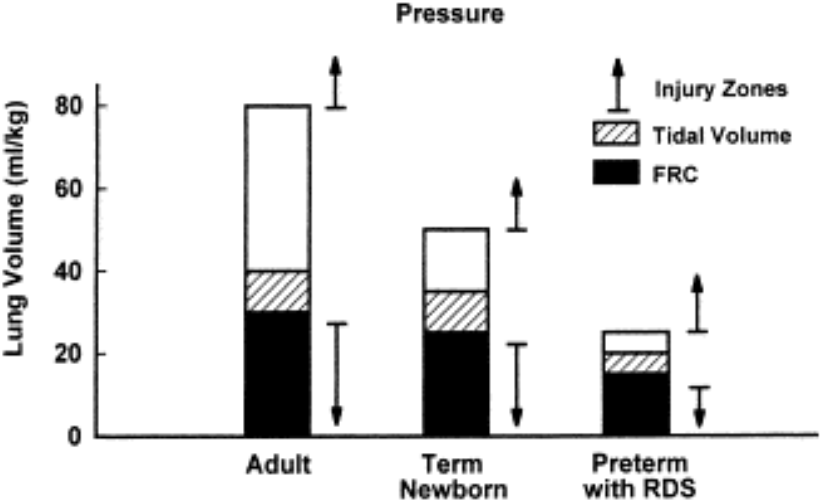
This frame shows lung volumes for a normal adult, a term newborn and a preterm with RDS, given in ml/kg.
The low and high volume injury zones are indicated by arrows. The preterm lung is susceptible to injury with ventilation because of the small volume/kg between the two injury zones.
Metoder for å redusere lungeskade
Forebygge atelektotraume
Lungen må åpnes opp/rekrutteres og man må forhindre at den klapper sammen i ekspirasjonen. Til dette brukes PEEP som må være høyere enn "closing pressure". En for høy PEEP vil imidlertid kunne forårsake hemodynamisk instabilitet og ev. øke risikoen for volutraume. Å bestemme "riktig" PEEP er vanskelig og baseres på klinisk vurdering og skjønn.
Generelt: Start med PEEP på 4–6 cm H2O. En benytter deretter klinikk (inndragninger), rtg thorax og spesielt oksygenbehov for å titrere seg frem til "riktig" PEEP. Grafisk lungemekanikk (trykk-volum-kurver = PV-kurver) kan også være til hjelp. Hvis det er svært flatt platå på PV-kurven kan det tale for overdistensjon. Ved nedsatt luftholdighet på rtg thorax og FiO2 (> 0,4) kan PEEP forsøkes økt gradvis til 8 cm H2O. Ved behov for enda høyere PEEP, bør man som regel gå over til høyfrekvensventilasjon (HFV)
Rekruttering både ved konvensjonell respirator og HFV bør gjøres av kompetent personell som har erfaring med respiratorbehandling for å unngå overrekruttering og skade. Diskuter med kollega med erfaring og/eller regionsykehus
Husk: Når lungen er rekruttert (oppklaring på rtg thorax og FiO2 < 0,3 bør PEEP reduseres gradvis til 5–6 cm H2O. Ellers risikerer man å bli liggende for høyt på PV-kurven med fare for overdistensjon. Surfactant kan også bidra til å rekruttere lungen med påfølgende behov for å justere ned en forbigående økt PEEP.
Forebygge volutraume
I dyremodeller er det vist at store tidalvolum (VT) gir lungeskade. Meta-analyser viser mindre lungeskade, hjerneblødning og redusert mortalitet ved bruk av tidalvolum-styrt respiratorbehandling (volume-targeted ventilation VTV) og dette er anbefalt behandling av premature med RDS. Passende VT for ekstremt premature er trolig 4–5 ml/kg. For premature med vekt < 750 g vil en ofte benytte VT på 5–6 ml/kg da flowsensor utgjør en relativt stor del av dødvolumet. Barn som utvikler BPD trenger også høyere VT (6–8 ml/kg, av og til opp mot 10 ml/kg) pga. økt dødvolum sekundært til dilatasjon av luftveier. Veldig lave VT (< 4 ml/kg) er antagelig ugunstig idet det fører til hyperkapni, hypoksi og økt respirasjonsarbeid.
Ved utbredte atelektaser vil ”fysiologiske” VT kunne overekspandere de åpne lungeavsnittene og forårsake lungeskade, noe som understreker betydningen av både å begrense VT og rekruttere lungen med ”adekvat” PEEP.
Ventilering
Etterstreb pCO2-verdier i normalområde.
Unngå hypokapni (pCO2 < 4,5 kPa) siden det er forbundet med økt risiko for hjerneskade hos premature, spesielt første levedager.
Permissiv hyperkapni innebærer bruk av lavere tidalvolum enn det som kreves ved normoventilasjon og aksepterer høyere pCO2-verdier så lenge pH > 7,22. Tidligere antok man at mulige fordeler ved permissive hyperkapni skyldtes en mer skånsom ventilasjon. En stor studie fra Tyskland (PHELBI-studie) viste imidlertid ingen fordeler ved å benytte en ventilasjonsstrategi med permissiv hyperkapni hos barn med FV < 1000 g, snarere heller en ikke-signifikant trend mot mere BPD, høyere dødelighet og mere hjerneblødning. En sekundæranalyse av SUPPORT-studien har også vist økt sykelighet assosiert med høyere pCO2-verdier. En «aktiv» tilnærming med å tillate ekstra høye pCO2 verdier under respiratorbehandling synes derfor ikke indisert.
Oksygenering
Både for mye og for lite oksygen er ugunstig. For barn med behov for ekstra oksygen bør oksygentilførsel som medfører SpO2 > 95 % unngås da slike verdier er assosiert med økt risiko for ROP. SpO2 < 90 % er imidlertid assosiert med økt dødelighet i store studier.
Vi anbefaler derfor ønsket målområde for SpO2 på 90–94 %.
Hva bestemmer oksygenering?
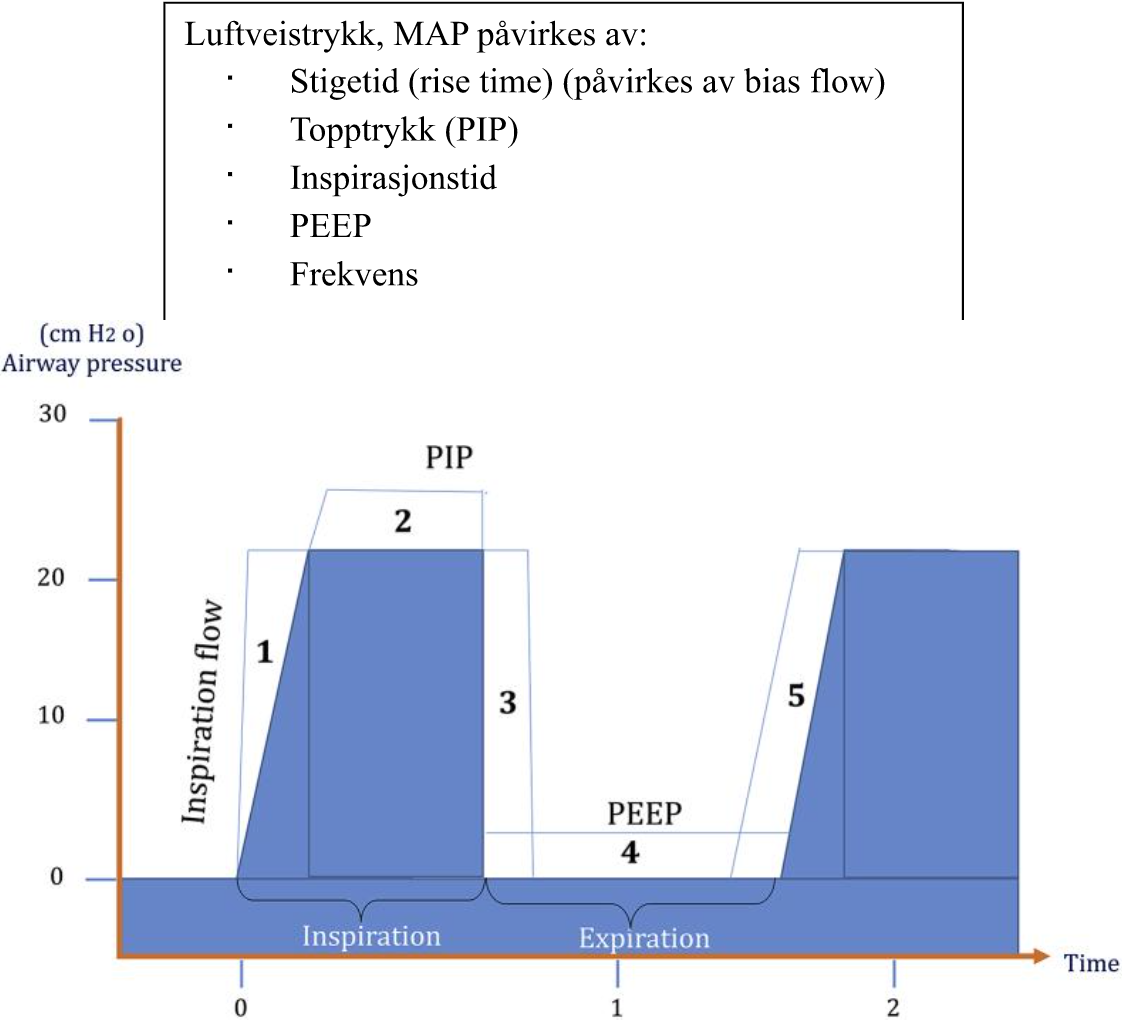
Generelt bestemmes oksygenering av MAP (mean airway pressure).
MAP påvirkes av stigetid, topptrykk, inspirasjonstid, PEEP og frekvens. For å bedre oksygenering må MAP økes, fortrinnsvis ved økt PEEP da dette er den faktoren som i størst grad påvirker MAP.
Hva bestemmer ventilasjon (CO2-utlufting)?
Ventilasjon bestemmes av respiratorisk minuttvolum (MV).
Ved konvensjonell respiratorbehandling er MV = frekvens x tidalvolum. «Vanlige MV-verdier» for å oppnå "normal" pCO2 er ofte rundt 0,25 (0,20–0,40) L/kg/min.
TIPS: MV bør noteres når man tar blodgass. Man kan så styre respiratorbehandling for å oppnå et ønsket MV, og dermed redusere bruk av transkutane/blodgass-verdier.
Respiratorbehandling og ulike respiratormodi
Det finnes en rekke ulike respiratormodi og nomenklatur kan til dels være forvirrende med ulike benevnelser på tilsynelatende like ventilasjonsmåter. Respiratorer som brukes til nyfødte er vanligvis primært «trykkstyrt» og med ulike triggede modi; se under. I tillegg kan man på alle moderne respiratorer i konvensjonell modus legge til en såkalt ”volume-targeted ventilation (VTV)”.
- Pasientrigget, synkronisert ventilasjon, muliggjort ved hjelp av følsomme flow-sensorer plassert på Y-stykket, er i dag standard på de aller fleste nyfødtavdelinger. Det er ingen store studier som viser at dette gir bedre langtidsresultater enn ikke-trigget ventilasjon, men ut ifra klinisk erfaring virker det mer behagelig for pasienten og det gir mindre behov for sedasjon for å unngå asynkroni. Pasientrigget, synkronisert ventilasjon kan også skje ved bruk av sensorer integrert i nasogastriske sonder som registrerer diafragma aktivitet (EDI-trigging ved NAVA ventilasjon).
- Det er holdepunkter for at VTV gir mindre hypokapni, lungeskade og hjerneskade enn ren trykkstyrt ventilasjon, og anbefales i de europeiske retningslinjene for respiratorbehandling av RDS.
- Hos små premature utgjør tuben den største motstanden i respiratorkretsen. Det synes derfor logisk at støtte på hvert pust reduserer respirasjonsarbeidet noe som også er vist i korttidsstudier. Dette er teoretisk gunstig spesielt hos de minste.
De vanligste triggede modi som benyttes er:
Assist control (AC) = Synchronized intermittent positive pressure ventilation (SIPPV)
Dette er en modus der respiratoren gir støtte på hvert pust barnet tar. Man stiller en PIP, PEEP og back-up frekvens som en «minimum frekvens» som respiratoren skal gi (ved apne eller utilstrekkelig trigging). Barnet bestemmer ellers selv frekvensen så lenge barnet puster raskere enn back-up-frekvensen. Inflasjonstiden (Ti) må innstilles og respiratoren gir den innstilte Ti uavhengig av pasientens spontane inspirasjonstid. Se under for hvordan man kan vurdere endring i inflasjonstid.
Pressure support ventilation (PSV)
Dette er en modus som i praksis veldig lik AC/SIPPV, bortsett fra at inflasjonen avsluttes når flow er falt til en viss prosentandel (enten fast 15 % eller innstilt mellom 10–25 %) av peak flow under inflasjon. Dette betyr at når pasientens lunger er nærmest helt fylt går respiratoren over til ekspirasjon. Dette kalles også «flow-cycling» eller synkronisert/trigget ekspirasjon. Ti bestemmes således av pasientens spontane Ti (som avhenger av luftveismotstand og compliance). Den innstilte Ti er kun en øvre grenseverdi. Den spontane Ti kan avleses når respiratoren er i PSV modus. Figuren under illustrerer prinsippet der inflasjonen kuttes ved fall av flow til 15 % av peak flow. Teoretisk bidrar dette til en bedre synkronisering mellom pasient og respirator. Av og til ser man imidlertid at barn som ventileres i PSV-modus har veldig kort avlest spontan Ti (< 0,20–25 s) og evt. samtidig puster fort. I slike tilfeller kan man forsøke å justere opp stigetid fra ”default 0,11 sek til f.eks 0,15–0,18 sek. Alternativt redusere bias flow fra f.eks 8 l/min til 6 l/min
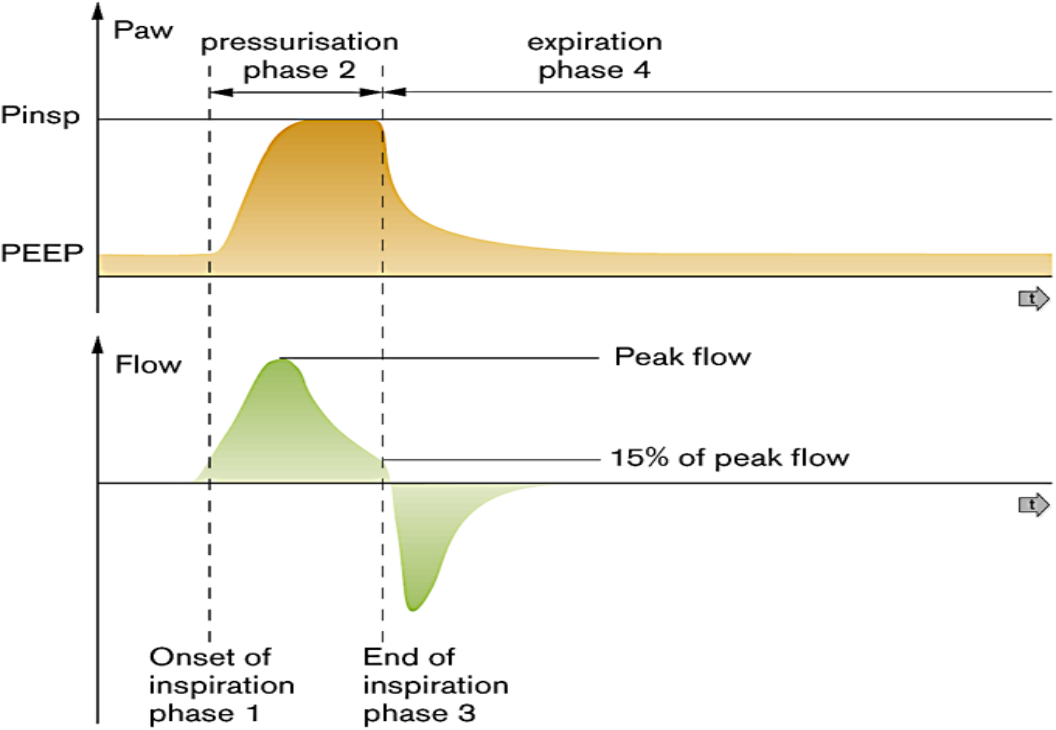
Synchronised intermittent mandatory ventilation (SIMV)
Dette er en modus der man stiller en frekvens, Ti, PEEP og PIP. Respiratoren gir ikke flere inflasjoner per minutt enn den innstilte frekvensen, men forsøker å tilpasse denne frekvensen til pasientens egne triggede pust. Respiratoren gir ingen støtte til pasientens spontane pust utover den innstilte respiratorfrekvensen. Det betyr at ved en innstilt frekvens på 30/min mens pasienten puster med en spontanfrekvens på 60/min så vil 30 av pasientens spontane pust bli støttet av respiratoren og 30 pust forblir uten noen støtte bortsett fra PEEP. Hvis man bruker SIMV med lavt innstilte frekvenser (f. eks 20/min) kan dette medføre økt respirasjonsarbeid for pasienten da en stor andel av pasientens egne pust blir uten støtte. Bruker man SIMV med høyere frekvenser (f.eks. 55/min) blir SIMV i praksis ikke så veldig forskjellig fra AC/SIPPV.
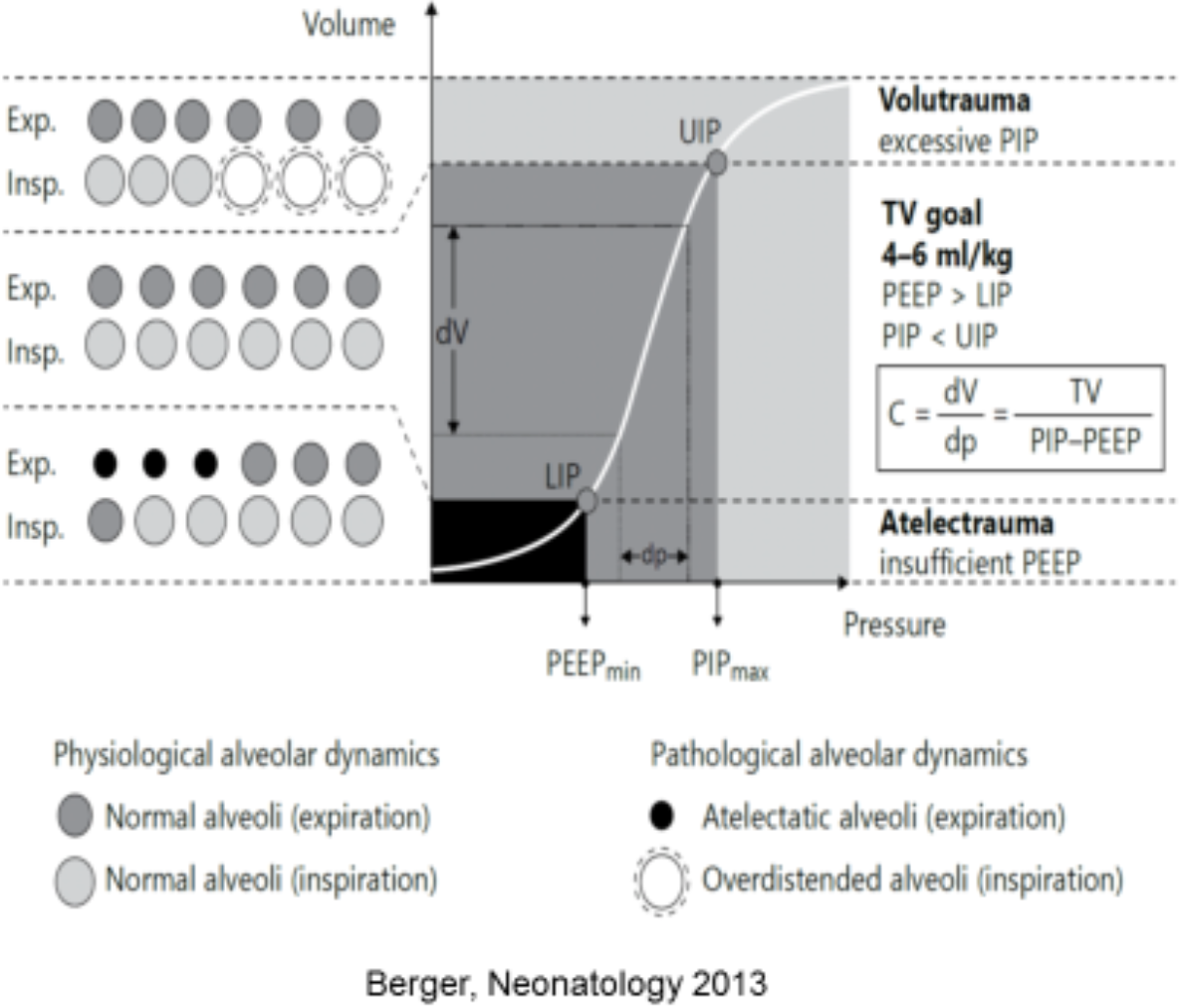
Volume-targeted ventilation (VTV)
Ulike respiratorer har noe ulike algoritmer for volumstyring, og ulike navn på hva dette heter. (f.eks VG; Volume Guarantee eller PRVC; Pressure Regulated Volume Control, etc.).
Hovedprinsippet er at man stiller inn et ønsket tidalvolum (VT). Respiratorens mikroprosessor regner automatisk ut hvilket PIP som må til for å nå det innstilte tidalvolumet (figur). Man velger også et topptrykk (PIP), men dette fungerer som en grenseverdi, dvs. maks. PIP (Pmax) man vil tillate. Oppnås ikke ønsket VT innenfor valgte innstillingene, vil ofte en "low VT"-alarm gå og man må vurdere å øke PIP (se nedenfor). Fordelen med VTV er at PIP justeres automatisk ned og man unngår for store VT og risiko for overdistensjon ved rask bedring i compliance. Det tidalvolumet (VT) som respiratoren faktisk gir vil svinge rundt det satte VT pga. den gradvise kompensasjonen og variasjoner i pasientens egenrespirasjon (foregående pust brukes for å justere PIP).
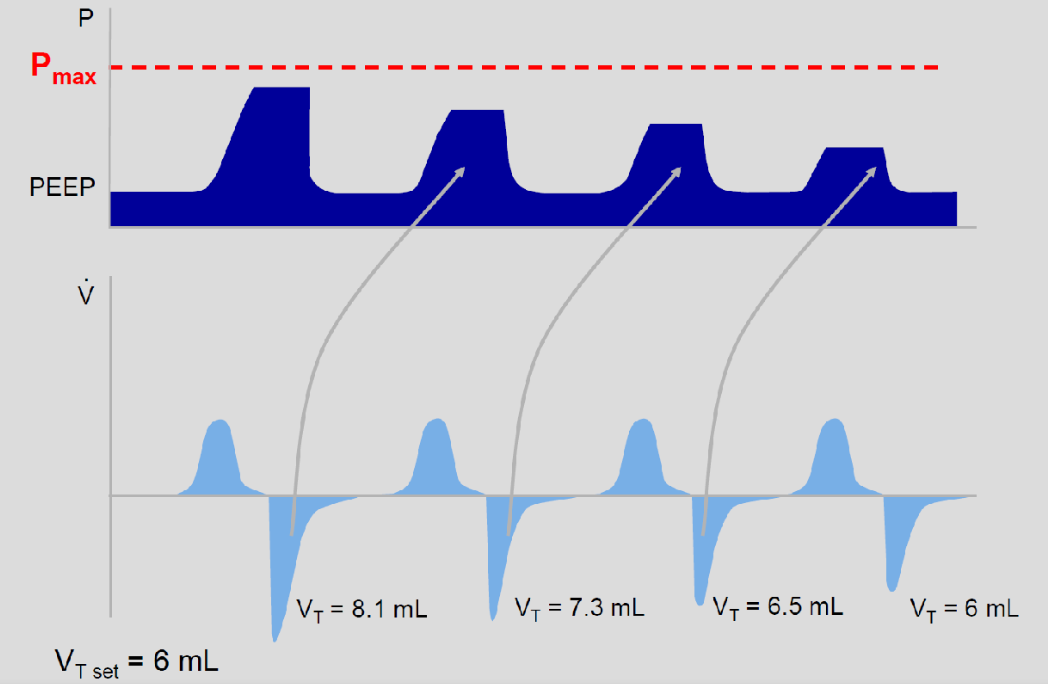
Inflasjonstiden
I både AC- og SIMV-modus stilles en inflasjonstid (Ti), men det kan tenkes at pasienten egentlig burde hatt en kortere eller lenger Ti. Dette kan vurderes på flow kurven, se under.
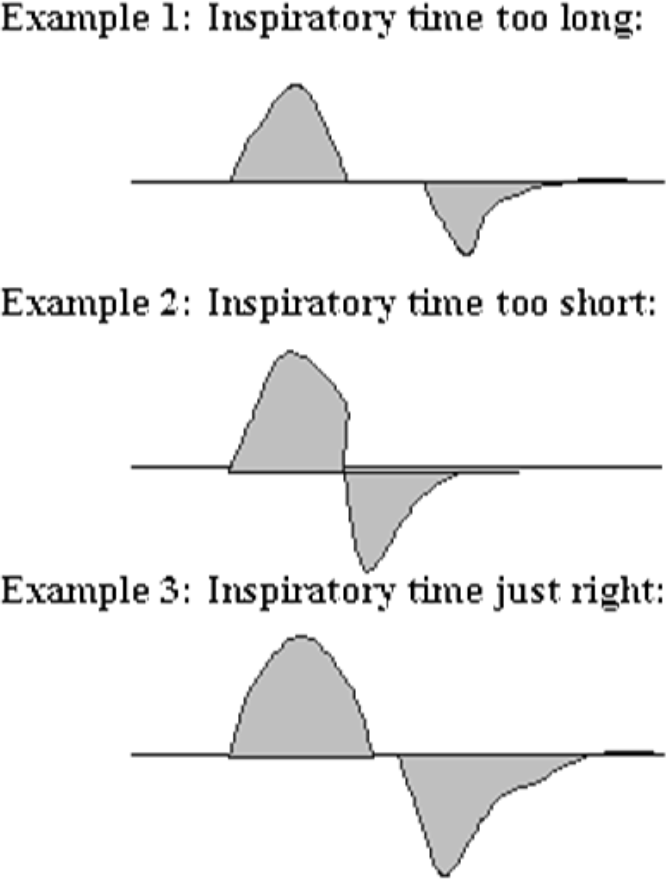
En «vanlig» initial respiratorbehandling kan være følgende
Premature med RDS: AC/SIPPV + VTV
Følgende innstillinger kan brukes som et utgangspunkt:
Ti 0,30–0,35 s
Back-up-frekvens: 50–60/min
Innstilt VT: 4–5 ml/kg (5–6 ml/kg hos barn med vekt < 750 g)
PEEP: 4–6 cm H2O
PIP 20–25 cm H2O (Pmax settes 15–20 % over trykkbehovet ved adekvat VT)
Trigger-sensitivitet: lavest innstilt (default).
Terminbarn med lungesykdom: AC/SIPPV + VTV
Følgende innstillinger kan brukes som et utgangspunkt:
Ti 0,38–0,40 s
Back-up-frekvens: 40–50/min.
VG: 4–5 ml/kg
PEEP: 4–5 cm H2O
PIP 20–25 cm H2O (Pmax settes 15–20 % over trykkbehovet ved adekvat VT)
Trigger-sensitivitet: lavest innstilt (default).
Avdelinger som har hatt SIMV som sitt førstevalg kan i praksis benytte samme initiale innstillinger i SIMV-modus. Eneste forskjellen er at frekvensen da er satt og ikke en back-up. Ved såpass høye frekvenser blir det liten forskjell mellom AC og SIMV. Vi fraråder å bruke lave frekvenser i SIMV-modus tidlig i forløpet hos et prematurt barn med RDS og høy spontan respirasjonsfrekvens. Lav terskel for å diskutere valg av behandling med noen som har erfaring med respiratorbehandling av nyfødte.
Videre forløp
Tidalvolumet justeres for å holde pCO2 5–7 kPa i første leveuke, etter det kan man akseptere høyere verdier PCO2 verdier. Vanlige endringer av VTset er 0,3 – 0,5 ml/kg om gangen.
Unngå PaCO2 < 4,5 kPa.
PIP-grensen (Pmax) justeres i forhold til endringer i lungestatus og det reelle PIP-behovet for å oppnå ønsket VT.
Pmax settes ca 5 cm H2O over antatt behov.
Viktig å justere ned Pmax ved bedring av lungefunksjonen.
Ved oksygeneringsproblemer må man vurdere hva dette kan skyldes. Hos premature kan en ny dose surfactant være nødvendig. Ved tette lunger kan PEEP økes. Vurder ev. pulmonal hypertensjon
Back-up-frekvensen senkes etter hvert ned mot 30–40/min når barnet er stabilt/avvenning begynt. Dette gjør det mulig for barnet å ha et visst (fysiologisk) periodisk respirasjonsmønster uten at respiratoren øyeblikkelig slår inn med back up inflasjoner.
Spesielle problemer eller funn
Takypne (vedvarende > 80/min) kan skyldes:
- Barnet puster fort for å kompensere for en metabolsk acidose. Behandle årsak til metabolsk acidose.
- Barnet puster fort, men med normale blodgasser. Dette kan skyldes at respirasjonsarbeidet er høyt fordi VTset er for lav, og barnet kompenserer med å puste raskt. Vurder å øke VTset, særlig hvis dette er satt relativt lavt.
- Takypne kan også skyldes "andre" forhold som at barnet er for varmt, har smerter eller er agitert av andre årsaker (støy, uro?). Korrigere underliggende årsak, ev. lett sedering.
- Auto-trigging (se eget avsnitt)
Barnet er hypo-/hyperventilert
Justere VTset. Økes ved CO2-retensjon (vurder om det også er behov for å øke PEEP, særlig ved samtidig høyt O2 behov). Ved tendens til hyperventilasjon reduseres VTset.
HUSK: Så lenge barnet puster raskere enn back up-frekvensen har det ingen hensikt å redusere frekvensen for å heve CO2.
Tubelekkasje
Ved bruk av automatic leak compensation angis det at respiratoren kan korrigere for tubelekkasje opptil 50–80 %. Hvis barnet er ustabilt respiratorisk og det er konstant høy tubelekkasje bør man imidlertid vurdere å skifte til større tube. Ev. kan man gå over til «vanlig» trykkstyrt ventilasjon, som i noen tilfeller «løser problemer». Stor og veldig svingende tubelekkasje kan være stillingsavhengig eller i enkelte tilfeller skyldes at barnet er i utakt med respiratoren, for eksempel ved auto-trigging. Korriger underliggende årsak. Sjekk også at ikke tuben står veldig høyt!
Low VT-alarm
Dette skyldes at VTset ikke nås med de grenser som er gitt for PIP, Ti og flow. Sjekk at det ikke er veldig høy lekkasje. Hvis dette ikke er tilfelle skyldes alarmen oftest at lungene er blitt stivere, og det er behov for økt trykk. Det riktige tiltaket er å øke PIP-grensen (Pmax), eller vurdere om høyfrekvensventilasjon (HFV) er aktuelt. Hos de minste premature vurderes HFV ved PIP > 25 cm H2O. Dessuten MÅ man kartlegge årsaken til endringen – ofte aktuelt med rtg thorax for å bedømme endringer i luftholdigheten eller om tube er i høyre hovedbronkus (lytt på lungene, er det sidelik respirasjonslyd?). Tiltakene varierer avhengig av årsak: for eksempel gi surfactant, justere tubeposisjon, øke PEEP ved tettere lunger starte HFV osv.
Auto-trigging
Enkelte ganger er barn og respirator i utakt, ofte er det variabel tubelekkasje og takypne. Dette kan skyldes auto trigging (respiratoren trigger uten at pasienten drar pusten) – studer flow-bølgene og pasientens thoraxbevegelser. Enhver luftbevegelse over flowsensor vil oppfattes som en trigger til inspirasjon. Vann i slanger (eller ekspirasjonsblokk) kan utløse slik luftbevegelse og kan føre til auto-trigging. Tubelekkasje kan også være årsak.
Tiltak: Fjerne vann i slanger, redusere tubelekkasje, i enkelte tilfeller redusere trigger-sensitivitet. Det siste betyr å øke den innstilte trigger-sensitiviteten.
Akutt forverring/hypoksi under respiratorbehandling
DOPE (Dislocated tube, Obstruction, Pneumothorax, Equipment failure)?
Ekstubering (aksidentell)?
- Se på flow-kurven. Ved ekstubasjon kan man se inspiratorisk flow, men ingen ekspiratorisk flow.
- Hvis tvil og man har tid, kikk ned med laryngoskop
- Bruk kapnograf og sjekk ekshalert CO2.
- Alvorlig problem: «When in doubt pull it out».
Obstruksjon/tett tube?
- Går det kun små tidalvolum inn og ut?
Pneumothorax?
- Sideforskjell i respirasjonslyd? Transilluminasjon? Stille pleura på ultralyd? Nedsatt sirkulasjon/vansker med å få inn SpO2 signal (trykkpneumothorax)?
Utstyrsvikt?
- Frakoblinger ved fukter, ved trykkmåler, Y-stykket etc.
- Respiratoren vil ikke gi det innstilte trykket. Kan sees ut fra på trykk-kurven. Andre tekniske problemer med respiratoren?
Avvenning fra respirator
Reduser back-up-frekvensen til f.eks rundt 30–40 etter hvert som lungene blir bedre (overfører mer av respirasjonsarbeid til barnet selv) og man ser for seg en ekstubering.
Start caffein (hvis ikke allerede gjort), ev ekstra dose/toppe opp før ekstubasjon.
En av fordelene med VTV er at avvenningen ofte skjer "automatisk" dersom man sørger for at VT er satt i den nedre del av normalområdet (rundt 4 ml/kg – høyere for barn med BPD) og tillater PaCO2 å stige opp på 6–7-tallet. Barnets egenrespirasjon øker og PIP reduseres da automatisk. Dersom avvenningen ikke skjer som forventet til tross for bedret lungefunksjon kan man redusere VT med 0,5 ml/kg såfremt blodgassene forblir tilfredsstillende og respirasjonsarbeid ikke synes å øke. Dersom O2-behovet er stort (øker) når PIP faller som ledd i avvenningen, bør man øke PEEP for å kompensere for fallet i MAP.
Når PIP stort sett ligger < 12–15 cm H2O og FiO2 < 0,30–0,35 og det ikke er apne-tendens, kan barnet ekstuberes. Enkelte barn svinger mer i PIP (12–20 cm H2O), men klarer seg uten eller minimalt med oksygen og har relativt klare lunger. Disse bør også vurderes ift ekstubasjon.
Før ekstubasjon har noen avdelinger en praksis å gjøre en «spontan pustetest på 3 min» der man vurderer om barnet holder metningen + hvordan barnets respiratoriske «drive» er etter at man skrur over til endotrakeal tube CPAP (se referanser 11–12). Hvis barnet har en 2.5 tube skal en slik test aldri vare mere enn 3 min.
Spesielle problemer ved avvenning
Noen barn utvikler gradvis en BPD når de ligger på respirator, avvenning går ikke automatisk. Dersom man lar disse bli liggende med relativt lave VT, "gror" de ofte igjen. Disse barna trenger ofte høyere VT pga økt dødvolum, lave frekvenser og lengre Ti på opptil 0,6–1,0 s pga. økt luftveismotstand. Dette er nærmest motsatt av hva som anbefales ved initial behandling av premature med RDS og krever en annen tilnærming. Se Logan JW et al.
Nyttig litteratur/referanser
- Sweet DG, et al. European consensus guidelines on the management of neonatal respiratory distress syndrome in preterm infants—2019 update. Neonatology. 2019; 115: 432-50.
- Logan JW, et al. Clinical phenotypes and management concepts for severe, established bronchopulmonary dysplasia. Paediatr Respir Rev 2019; 31: 58-63
- Klingenberg C, et al. A practical guide to neonatal Volume Guarantee ventilation. J Perinatology, 2011; 31: 575-85.
- Klingenberg C, et al. Volume-targeted versus pressure-limited ventilation in the neonate. Cochrane Database Syst Rev. 2017;10:CD003666
- Nassabeh-Montazami S, et al. The impact of instrumental dead-space in volume-targeted ventilation of the extremely low birth weight (ELBW) infant. Pediatr Pulmonol. 2009; 44: 128-33.
- Keszler M, et al. Evolution of tidal volume requirement during the first 3 weeks of life in infants <800g ventilated with Volume Guarantee. Arch Dis Child Fetal Neonatal Ed. 2009; 94: F279-82.
- Thome UH et al. Permissive hypercapnia in extremely low birthweight infants (PHELBI): a randomised controlled multicentre trial. Lancet Respir Med. 2015; 3: 534-43.
- Reiterer F, et al. Lung-protective ventilatory strategies in intubated preterm neonates with RDS. Paediatric respiratory reviews 2017; 23: 89-96.
- Norman M, et al. Respiratory support of infants born at 22–24 weeks of gestational age. Semin Fetal Neonatal Med 2022; 101328
- De Luca D, et al. Flow-cycled versus time-cycled sIPPV in preterm babies with RDS: a breath-to-breath randomised cross-over trial. Arch Dis Child Fetal Neonatal Ed 2009;94: F397–401
- Kaczmarek J, et al. Variability of respiratory parameters and extubation readiness in ventilated neonates. Arch Dis Child Fetal Neonatal Ed 2013;98: F70–3.
- Kamlin CO, et al. Predicting successful extubation of very low birthweight infants. Arch Dis Child Fetal Neonatal Ed 2006; 91: F180–3.
- Ohnstad MO, et al. Duration of Mechanical Ventilation and Extubation Success among Extremely Premature Infants. Neonatology 2021; 118: 90-7.
- Berger TM, et al. Lung Protective Respiratory Support in Preterm Neonates. Neonatology 2013; 104: 265–74










