Nyfødtveileder
8 Gulsott og hemolytisk sykdom
8.1 Tidlig gulsott
Sist faglig oppdatert: 20.01.2026
Håvard Ur, Ragnhild Støen, Claus Klingenberg, Ingebjørg Hagen Agøy, Kristin Brække, Gro Flagstad, Lea Larsen, Marianne Leirvik, Guro Lenes, Anne Lee Solevåg, Loes van Den Berg og Anlaug Vatne
Bakgrunn
- Bilirubin er et nedbrytningsprodukt av hemoglobin.
- I plasma er hovedandelen av ukonjugert bilirubin bundet til albumin, mens en liten andel er fritt ukonjugert bilirubin.
- Ukonjugert bilirubin blir transportert til leveren og blir der konjugert (= gjort vannløselig). Konjugert bilirubin kan så skilles ut i gallen.
Ukonjugert bilirubin, som ikke er bundet til albumin (= fritt ukonjugert bilirubin), kan passere blod-hjerne barrieren og er nevrotoksisk. Dette kan gi synlig gulfarge i basalgangliene (kjernene) og andre deler av hjernen, og har gitt opphav til begrepet «kjerneikterus».
Konjugert bilirubin er ikke nevrotoksisk, men forhøyede verdier kan indikere alvorlig grunnsykdom (lever/galle).
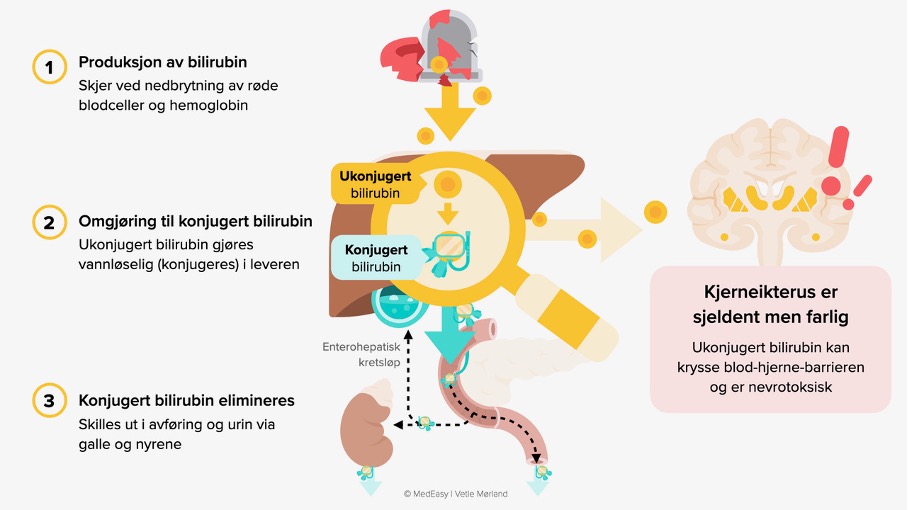
Årsaker til gulsott hos nyfødte
Fysiologisk gulsott
- Friske nyfødte produserer dobbelt så mye bilirubin/kg/dag som voksne.
- Hos nyfødte er den fysiologiske metabolismen av bilirubin begrenset, inkludert:
- overgangen av ukonjugert bilirubin fra plasma til levercellen
- konjugering av bilirubin i levercellen
- utskillelsen av konjugert bilirubin til gallen
Disse mekanismene er spesielt umodne hos premature.
- Nyfødte har økt enterohepatisk resorpsjon av bilirubin fra tarm, spesielt før ernæringen er godt etablert.
Samlet forårsaker dette «fysiologisk gulsott» i nyfødtperioden.
Immunisering (antistoff-mediert gulsott)
ABO-uforlikelighet
- Omtrent 15–20 % av alle svangerskap er ABO-uforlikelige.
- ABO-uforlikelighet gir svært sjeldent hemolytisk sykdom (immunisering); kun ca. 1 % av alle nyfødte.
- Det kan være utfordrende å identifisere nyfødte med immunisering og hemolytisk sykdom blant alle med ABO-uforlikelighet. Følgende kan brukes til vurdering:
- Debut av gulsott i første levedøgn
- Biokjemiske tegn til hemolyse (anemi, reticulocytose)
- Direkte antiglobulin test (DAT) er positiv i rundt 1/3 av tilfeller med hemolytisk sykdom som følge av ABO-immunisering.
- Styrken på en positiv DAT er ikke nødvendigvis korrelert med graden av hemolyse.
RhD-uforlikelighet
- Omtrent 15 % av norske kvinner er Rhesus D (RhD)-negative, og hvis fosteret er RhD-positivt kan mor danne antistoffer mot fosterets erytrocytter som passerer placenta og gir hemolyse (immunisering).
- Alvorlig Rh-immunisering ses i dag sjelden, men obs. kvinner med tidligere svangerskap i land uten rhesus-screening/profylakse.
- Gjeldende retningslinjer følger Veileder i gynekologi og fødselshjelp (Metodebok).
- Alle gravide screenes med ABO- og RhD-typing og antistofftiter i uke 12.
- Det gjøres føtal RhD-typing i uke 18–24 av alle RhD-negative kvinner.
- RhD-negative kvinner med RhD-positivt foster følges med overvåkning av antistofftiter, og det gis anti-D profylakse i svangerskapsuke 28 og rett etter fødsel.
- Barnet kan ha svakt positiv DAT på grunn av anti-D profylakse.
Annen blodgruppeuforlikelighet gir sjelden alvorlig hemolytisk sykdom. Ved påvisning av alloantistoffer utenom anti-D i uke 12 (anti-c, anti-E, anti-K m.fl.), kontrolleres dette med intervaller avhengig av type antistoff (hyppigste kontroller ved påvist anti-K).
Andre risikofaktorer eller årsaker til gulsott (ukonjugert)
Vanlig årsaker:
- Tilstander som gir økt mengde erytrocytter som skal brytes ned, f.eks. polycytemi (hyppigere hos barn av mødre med diabetes), kefalhematom, andre store hematomer etc.
- Stort postnatalt vekttap pga. lite mat og dermed økt enterohepatisk resorpsjon.
Sjeldne årsaker:
- Glukose-6-fosfat dehydrogenases (G6PD)-mangel: Dette er den hyppigst forekommende enzymmangelen i erytrocytter, ses primært hos personer med genetisk opphav fra Asia, Afrika og rundt Middelhavet. Forskjellige genvarianter disponerer for hemolytiske tilstander av varierende alvorlighetsgrad. Siden barn med genetisk opphav fra Afrika ellers har en noe lavere insidens og alvorlighetsgrad av fysiologisk nyfødtgulsott bør G6PD-mangel mistenkes/utredes hos barn med slik etnisk bakgrunn som utvikler alvorlig gulsott. Testing av G6PD aktivitet omtales her.
- Medfødte infeksjoner
- Medfødt metabolsk sykdom
- Medfødt hypotyreose
Symptomer og klinikk
- 60–80 % av alle nyfødte får synlig gulsott (totalt serum bilirubin (TSB) > 80–90 μmol/L). Graden av visuelt bedømt gulsott korrelerer dårlig med TSB.
- Utover synlig gul hudfarge fremstår barn med fysiologisk gulsott vanligvis friske.
- Ved uttalt gulsott blir noen barn trøtte og spiser dårlig.
- Høyeste bilirubinverdier ved fysiologisk gulsott nås oftest mellom 72–120 timers alder
- Nevrologiske symptomer forenlig med akutt bilirubinencefalopati: Økt tonus, retrocollis, opistotonus, feber, høyfrekvent skrik (svært sjeldent)
Synlig gulsott med debut før 24 timers alder kan være utrykk for hemolyse, og krever rask avklaring/utredning.
Diagnostikk og utredning
Klinisk generell vurdering inkl. av gulsott, samt hvordan barnet dier og vektnedgang.
Transkutan bilirubin (TcB)
- TcB er en non-invasiv, smertefri og tidsbesparende metode for å måle bilirubin. Målingen er uavhengig av barnets hudfarge.
- TcB anbefales som førstevalg ved klinisk tegn på gulsott og ved poliklinisk oppfølging i etterkant av en ukonjugert gulsott.
- Panne og eventuelt sternum er foretrukne områder for undersøkelse, grunnet minst diskrepans mellom TcB og totalt serum bilirubin (TSB).
- TcB bør tas kort tid før ordinære blodprøverunder slik at ev. kontroll med TSB kan tas på ordinær prøverunde.
- TcB skal ikke benyttes under pågående lysbehandling, men kan/bør brukes fra 18 timer etter avsluttet lysbehandling.
- Nedre grenser for gestasjonsalder som kan benytte TcB, varierer mellom type utstyr, her må man følge veiledning fra produsent.
Total serumbilirubin (TSB)
TSB er mer presis enn TcB og representerer «gullstandarden». TcB skal kontrolleres med TSB ved:
- TcB mindre enn 50 μmol/L fra lysbehandlingsgrense for aktuell gruppe og alder
- Enhver verdi av TcB > 275 μmol/L uavhengig av barnets alder
Transkutan bilirubin av alle barn («screening»)
- Det anbefales å ta TcB av alle barn kort tid før nyfødtscreeningen slik at ev. kontroll med TSB kan tas i samme stikk som screeningen. Indikasjon for kontroll med TSB er som beskrevet i forrige avsnitt.
- TcB verdier som ikke trenger kontroll med TSB krever i utgangspunktet ingen videre oppfølging, men ved klinisk tegn på økende gulsott gjentas en TcB.
- Hvis en TcB har medført en kontroll med TSB, og TSB er mindre enn 20 μmol/L fra grensen for lysbehandling, bør man kontrollere med ny TcB etter rundt 1 døgn.
Annen blodprøvetaking
Det er ikke rutinemessig behov for andre blodprøver enn TSB ved oppstart fototerapi.
Det tas i tillegg Hb, retikulocytter, blodtype og DAT sammen med første TSB hvis:
- Mor har blodtype O
- Mor har blodtype RhD-negativ og det ikke foreligger informasjon om føtal RhD-status eller antistoffer i svangerskapet (denne informasjon foreligger vanligvis)
- Mor har fått påvist andre typer erytrocytt-antistoffer under svangerskapet
Om ikke allerede tatt, tas de de samme blodprøvene (Hb, reticulocytter, blodtype og DAT) sammen med den andre TSB-målingen hvis:
- Behandlingskrevende gulsott første 24 timer
- TSB > 400 μmol/l
Avhengig av eventuell annen underliggende årsak, eksempelvis sepsis eller mistanke om metabolsk sykdom, tas andre aktuelle blodprøver på indikasjon.
Følgende funn indikerer hemolyse p.g.a. immunisering:
- Blodgruppeuforlikelighet kombinert med høy ukonjugert bilirubin (spesielt i første levedøgn og/eller behov for gjentatte lysbehandlinger)
- + en av følgende:
- Tidlig anemi (Hb < 13,5 g/dl)
- Økt andel retikulocytter (> 6–7 %). Ved immunisering og anemi kan andelen reticulocytter stige til langt over 10 %. Andel reticulocytter er også høyere hos premature enn fullbårne (en øvre grense på 6–7 % angis primært for fullbårne).
- Positiv DAT
Behandling og oppfølging
Når skal man behandle gulsott?
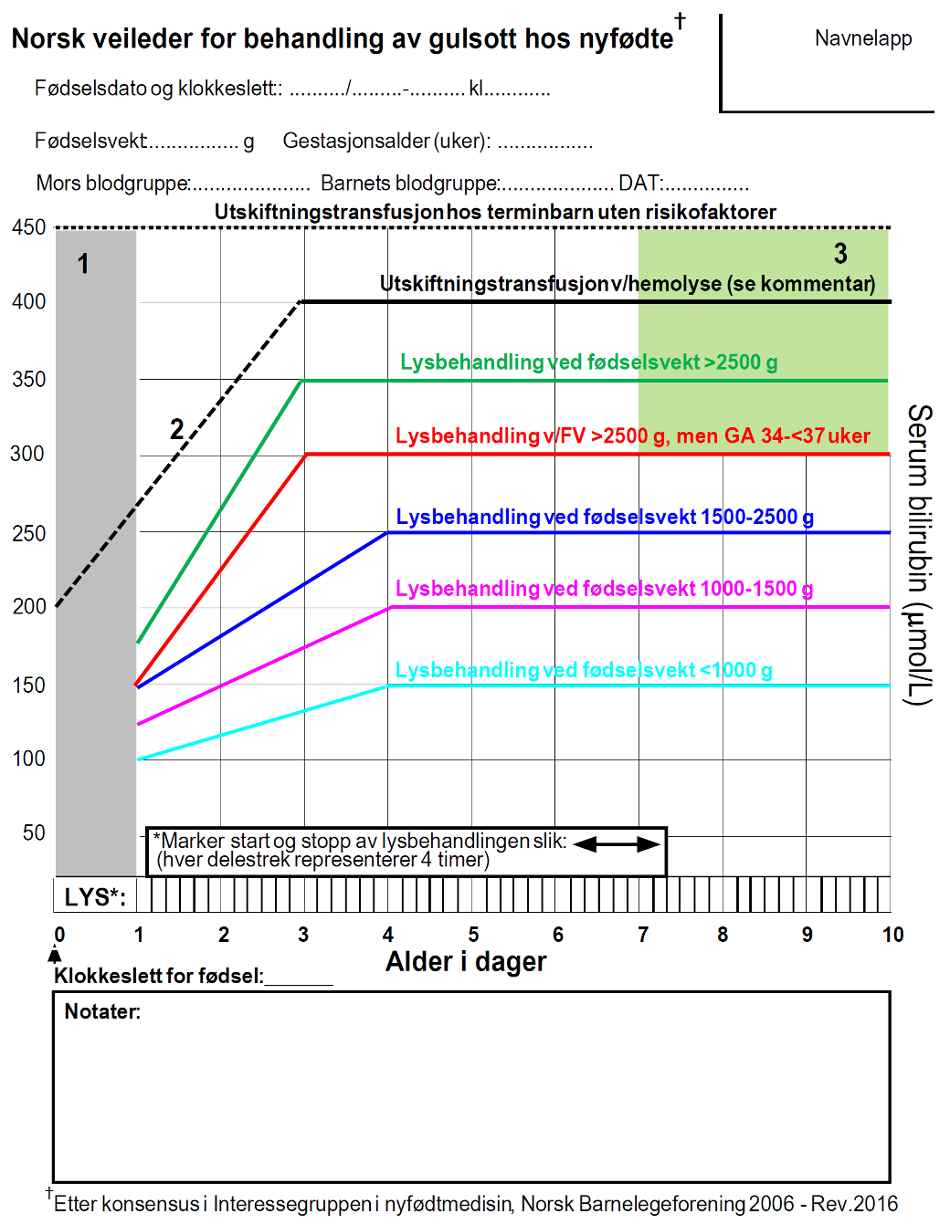
I Norge følges skjema med grenseverdier fra «Norsk veileder for behandling av gulsott hos nyfødte» fra 24 timers alder til barnet er 10 dager gammelt. Skjema med grenseverdier for lysbehandling kan også brukes etter 10 dagers alder, men vi anbefaler da å bruke aktuell vekt/postmenstruell alder på barnet.
Ved alder under 24 timer foreslås behandlingsgrenser (fototerapi) i tabell under. Dersom barnet er alvorlig sykt (eksempelvis sepsis eller asfyksi), vurder å senke behandlingsgrensen med 50 μmol/L. Verdiene er basert på en kombinasjon av nord-amerikanske, britiske og danske retningslinjer.
Tabell 1. Grenser for fototerapi (μmol/L) første 24 timer.
| Alder | FV > 2500 g | FV > 2500 g GA 34–36 uker | FV 1500 g–2500 g | FV 1000–1500 g | FV < 1000 g |
| 0–12 timer | 133 | 108 | 100 | 100 | 100 |
| 13–23 timer | 154 | 129 | 123 | 100 | 100 |
Fødselsvekt (FV) og gestasjonsalder (GA)
Forebygging av tidlig gulsott består av tidlig og tilstrekkelig enteral ernæring.
Enteral ernæring under pågående lysbehandling
Hos alle nyfødte som lysbehandles, er det viktig at tarmen tilføres melk som kan bidra til å binde og transportere ut bilirubinet via tarmen. Utilstrekkelig kaloriinntak og/eller dehydrering kan forverre gulsott hos nyfødte. Mødre anbefales å legge barnet til brystet tidlig og hyppig (mor-barn-vennlig initiativ). Barn med gulsott som lysbehandles, skal tas ut og ammes som vanlig (f.eks. pauser i opptil 20–30 minutter hver tredje time). For barn med
bilirubin på eller over utskiftningsgrensa og nevrologiske symptomer, skal behandling ikke avbrytes før TSB er under lysbehandlingsgrensa og disse vil trenge sondeernæring.
Mors egen melk foretrekkes som ernæring, hvis ikke tilgjengelig gis morsmelkerstatning. Hos fullbårne, friske barn gis ikke rutinemessig ekstra væske i forbindelse med fototerapi.
Fototerapi
- Fototerapi gjør at fettløselig, ukonjugert bilirubin omdannes til vannløselige fotoisomerer av bilirubin som skilles ut i tarm.
- Det anbefales minimum 12–24 timers lysbehandling for å redusere antall stikk, men dette kan individualiseres f.eks. hos barn som trenger blodprøver av andre årsaker før det har gått 12 timer.
Valg av lyskilde
Enkelt lys, ved hjelp av myke fiberoptiske madrasser/vester anbefales som førstevalg. Dette gjør at foreldrene har mest mulig tilgang til barnet sitt. Hvis alternativt er å bruke en lyskilde over barnet (overlys), skal avstanden mellom lyskilden og barnet vanligvis være 20–40 cm.
Dobbelt lys (fiberoptiske madrass under barnet og lyskilde over barnet) er rapportert å redusere TSB etter 12 og 24 timer med henholdsvis 39 % og 58 % sammenlignet med 30 % og 47 % med enkelt lys. Dobbelt lys anbefales derfor ved TSB som nærmer seg utskiftningsgrensen og ved høye verdier/rask stigning der man mistenker bakenforliggende sykdom. Dobbelt lys kan også brukes f.eks. ved ønske om tidlig hjemreise.
Ved svært høye bilirubinverdier (TSB > 450–500 μmol/L) ± nevrologiske symptomer på akutt bilirubinencefalopati anbefales bruk av reflekterende flater (hvitt laken innvendig rundt sengen og hvitt forheng rundt lyskassen), og avstanden mellom overlyset og barnet reduseres til 15–20 cm. Barnet bør da være innlagt ved en nyfødtavdeling og ha overvåkning med minimum metningsmåler.
Fototerapi kan gi løs grønnlig avføring og temperaturinstabilitet. Lyset avgir ikke varme.
Barnets øyne dekkes under behandlingen av en lystett maske eller spesiallagede briller. Bleie og briller bør dekke minst mulig av huden (ikke lue på hodet).
Barn med en ukomplisert fysiologisk gulsott som for øvrig er hjemreiseklar, kan tilbys fototerapi i hjemmet hvis avdelingen har tilgang til dertil egnet utstyr. Det må i så fall utarbeides lokale prosedyrer med foreldreinformasjon, retningslinjer for hvilke observasjoner foreldre skal gjøre hjemme, rutiner for prøvetaking (TcB og TSB) og klare avtaler om oppfølging av f.eks. avansert hjemmesykehus/nyfødtambulerende sykepleiertjeneste.
Kontrollprøver under og etter lysbehandling
- Ved tidlig gulsott (første 24 timer), svært høye verdier (> 400 μmol/L) eller mistanke om alvorlig hemolytisk sykdom, bør det vurderes å ta kontroll TSB 6 timer etter oppstart lysbehandling.
- Ved «ukomplisert» gulsott uten mistanke om bakenforliggende sykdom, kan man følge et av de to angitte alternativer nedenfor for kontroller.
Videre kontroller - alternativ 1:
- TSB kontrolleres første gang innen 12–24 timer etter oppstart lysbehandling eller før barnet tas ut av lys.
- Kontroll under/før avsluttet lysbehandling kan droppes hvis barnet har vært i lys tidligere og respondert godt på dette.
- Neste kontroll av inneliggende pasienter: TcB 18–48 timer etter avsluttet lysbehandling og fortrinnsvis kort tid før ordinær blodprøverunde i tilfelle behov for TSB.
- Neste kontroll av polikliniske pasienter: TcB 1–3 dager etter avsluttet lysbehandling. Ved ukomplisert gulsott med sakte stigende verdier, kan kontrollene utsettes lenger avhengig av stigningshastighet på bilirubin (hvis kjent), vektutvikling og allmenntilstand hos barnet.
Videre kontroller - alternativ 2:
- Bilirubin kontrolleres første gang 12–24 timer etter avsluttet fototerapi.
- Hvis < 18 timer etter avsluttet lysbehandling: Kontroll tas med TSB (ikke TcB).
- Hvis > 18 timer etter avsluttet lysbehandling. Kontroll tas med TcB.
Hva vurderes med tanke på behov for flere kontroller?
- Videre kontroller vurderes individuelt avhengig av respons på lysbehandling, synlig gulsott, vekttap/ernæring, og eventuell bakenforliggende patologi (f.eks. immunisering).
- Generelt vil man oftest kunne avslutte kontroller når TSB er under 280–300 μmol/L eller TcB < 250 μmol/L hos terminfødte.
- Hos premature må kontrolleres vurderes individuelt og avhengig av aktuell lysbehandlingsgrense.
- For vedvarende høy bilirubin utover første 2–3 uker, vises til kapitel om Langvarig gulsott.
Foreldreinformasjon
- Foreldre informeres om å ta kontakt med sykehuset dersom de mener barnet får økende gulsott eller om barnet virker slapt eller sykt, de første to ukene etter fødsel.
- Foreldre informeres om å ta kontakt med fastlege/helsesykepleier hvis barnet er synlig gult utover 2–3 ukers alder.
Intravenøs immunoglobin (IVIG)
IVIG kan gis for å hindre utskiftningstransfusjon ved alvorlig immunisering (vanligvis Rh). Man antar at IVIG blokkerer reseptorer i det retikuloendoteliale system som bidrar til hemolyse ved binding av maternelle antistoffer ved alloimmunisering.
Intensiv lysbehandling fortsettes under IVIG-infusjon.
- Ved Hb < 10 g/dl vil man vanligvis gjøre utskiftningstransfusjon først. IVIG kan vurderes etter utskiftingstransfusjon.
- Ved Hb mellom 10 og 12 g/dl kan man gi SAG 15 ml/kg og IVIG.
Prosedyre for IVIG behandling
- Optimal lysbehandling med dobbelt lys iverksettes umiddelbart/fortsettes samtidig som man forbereder IVIG behandling.
- Gi IVIG infusjon 500 mg/kg: Første 30 minutter i rate 50 mg/kg/t. Deretter økes infusjonsraten til 220 mg/kg/t slik at infusjonen går inn på totalt ca 2,5 timer. Se forslag til administrasjonsskjema.
- Ny kontroll TSB 4–6 timer etter fullført infusjon. Hvis verdien er fallende, fortsettes lysbehandling. Hvis TSB stiger, kan ev. samme dose IVIG gjentas etter 12 timer.
- Obs. Behandling med IVIG medfører ikke” utvasking” av antistoffer som ved en utskiftningstransfusjon. Dette medfører økt risiko for sen anemi (se under).
Utskiftningstransfusjon
- Grenser for utskifting ved samtidig hemolyse er gitt av behandlingsskjema (for terminfødte).
- Hos premature kan man under pågående, effektiv lysbehandling legge indikasjonen for utskiftningstransfusjon 50–100 μmol/L høyere enn de angitte grensene for fototerapi. Hver enkelt pasient bør vurderes individuelt siden risikoen ved utskiftingstansfusjon øker med synkende gestasjonsalder og komorbiditet.
- «Tommelfingerregel»: Utskiftningsgrensen = 10 x barnets gestasjonsalder i uker.
- I tillegg bør det sterkt vurderes utskifting ved lavere bilirubinverdier enn behandlingsskjema tilsier ved høye maternelle anti-RhD titer (> 1024) og/eller hvis barnet er anemisk (Hb < 10 g/dL) og/eller bilirubinverdien i serum stiger raskere enn 10 μmol/L per time.
- NB. optimal lysbehandling iverksettes umiddelbart og samtidig som man forbereder utskiftning (ev. også før prøvesvar foreligger). Effekten av intensiv fototerapi kan være svært god ved høye bilirubinverdier, og kan i noen tilfeller gjøre at man unngår utskiftning.
- Se ellers egen prosedyre for utskiftningstransfusjon.
Oppfølging etter immunisering
Sen anemi
Ved alloimmunisering kan det oppstå både tidlig anemi (første leveuke) og sen anemi (etter første leveuke). Det er liten risiko for sen anemi ved ABO-immunisering. En sen anemi utvikler seg vanligvis mellom to og seks uker etter fødselen og forsvinner vanligvis innen 3 md. alder. Den er patofysiologisk delt inn i to typer:
- Sen hyporegenerativ anemi: Forårsaket av en ineffektiv erytropoiese med lavt retikulocytt-tall. Patogenesen er ikke helt avklart. Intrauterine transfusjoner synes å øke risikoen for denne type sen anemi.
- Sen hemolytisk anemi: Forårsaket av en kombinasjon av antistoffmediert hemolyse og naturlig reduksjon i Hb-nivå hos et voksende spedbarn. Man ser normale eller forhøyede retikulocytter, og ev. vedvarende lett forhøyede bilirubinverdier.
Blodprøvekontroller etter immunisering
- Ved RhD-immunisering behandlet med IVIG og/eller utskifting, kontrolleres Hb hver til hver annen uke de første 4 ukene. Deretter hver 7–14(–21) dag frem til 3 md. alder. Foreldre kontakter fastlege og avtaler direkte oppfølging der.
- Risikoen for sen anemi er vesentlig lavere etter utskiftingstransfusjon enn etter IVIG. Det lengste oppfølgingsintervallet kan derfor velges for dem som har fått utskiftingstransfusjon.
- Ved RhD-immunisering kun behandlet med fototerapi kontrolleres Hb 2 og 4 uker etter utskrivelse. Deretter månedlig frem til 3 md. alder. Hyppigere kontroller hvis man ser raskt fall i Hb.
- Ved ABO-immunisering er det ikke nødvendig med kontroller av Hb hvis ikke barnet har vært anemisk (Hb < 13,5 g/dl) i løpet av første leveuke. Det bør tas Hb av barnet ved ca. en ukes alder eller før hjemreise. Ved tidlig anemi pga. ABO-immunisering, kontrolleres Hb tilsvarende RhD-immuniseringer som kun har vært lysbehandlet.
Behandling
Blodtransfusjon (SAGM 15 ml/kg): Behov for en eller flere transfusjoner er relativt vanlig ved sen anemi sekundært til særlig RhD-immunisering.
Blodtransfusjon gis hvis Hb faller raskt, veiledende grenser for transfusjon er:
- Hb < 8 g/dl ved 1 md.
- Hb < 7 g/dl ved 2 md.
Hvis barnet er blek, slapp og spiser dårlig vil en vurdere transfusjon på høyere verdier.
Jern: Det bør måles ferritin før oppstart av jerntilskudd hvis barnet har fått blodtransfusjon(er). Ved ferritin > 300 μg/L (uten samtidig leversykdom eller pågående inflammatorisk tilstand), skal det ikke gis jerntilskudd.
Referanser og litteratur
- Kemper AR, et al. Clinical Practice Guideline Revision: Management of Hyperbilirubinemia in the Newborn Infant 35 or More Weeks of Gestation. Pediatrics. 2022; 150: e2022058859
- Veileder i fødselshjelp. Alloimmunisering mot erytrocytt-antigener. https://metodebok.no/emne/kVJQSLtP/alloimmunisering-med-erytrocytt-antigener-(2023)/f%C3%B8dselshjelp-(ngf)
- Smits-Wintjens VEHJ, et al. Rhesus haemolytic disease of the newborn: Postnatal management, associated morbidity and long-term outcome. Semin Fet Neonat Med 2008; 13:265-71.
- Grabenhenrich J, et al. Transcutaneous bilirubin after phototherapy in term and preterm infants. Pediatrics 2014; 134:e1324-9.
- Mreihil K, et al. Uniform national guidelines do not prevent wide variations in the clinical application of phototherapy for neonatal jaundice. Acta Paediatr 2018; 107:620-7.
- Mreihil K, et al. Phototherapy is commonly used for neonatal jaundice but greater control is needed to avoid toxicity in the most vulnerable infants. Acta Paediatr 2018; 107:611-9.
- Hansen TWR, et al. Sixty years of phototherapy for neonatal jaundice: from serendipitous observation to standardized treatment and rescue for millions. J Perinatol. 2020; 40:1582-3.
- Johnson SM, et al. Validation of transcutaneous bilirubinometry during phototherapy for detection and monitoring of neonatal jaundice in a low-income setting. Paediatr Int Child Health 2020; 40:25-9.
- Amos RC, et al. Jaundice in newborn babies under 28 days: NICE guideline 2016 (CG98). Arch Dis Child Educ Pract Ed 2017; 102:207-9.
- Hansen TWR. The epidemiology of neonatal jaundice. Pediatr Med 2021; 4: 18.
- Keir A et al. How to use: the direct antiglobulin test in newborns. Arch Dis Child Educ Pract Ed 2015; 100:198-203.
- UpToDate. Alloimmune hemolytic disease of the newborn: Postnatal diagnosis and management
- Ree IMC, et al. Neonatal management and outcome in alloimmune hemolytic disease. Expert Rev Hematol. 2017;10:607-16.
- Mustafa HJ, et al. Monitoring and management of hemolytic disease of the fetus and newborn based on an international expert Delphi consensus. American journal of Obstetrics and gynecology 2025
- Guidelines for detection and management of hyperbilirubinemia in term and late preterm newborns (≥35 weeks gestational age). Canadian pediatric society. Position statement. Mar 18, 2025. https://cps.ca/en/documents/position/hyperbilirubinemia-newborns
- Bizzarro MJ, et al. Differential diagnosis and management of anemia in the newborn. Pediatr Clin North Am 2004; 51:1087e107
- van den Esker-Jonker B, et al. Transcutaneous bilirubinometry in jaundiced neonates: a randomized controlled trial. Pediatrics. 2016; 138(6):e20162414.
- Westenberg LEH, et al. Universal Transcutaneous Bilirubin Screening in a Midwifery-Led Home Care Setting. JAMA Netw Open. 2026 Jan 2; 9(1):e2551883.
Tidligere versjoner
Versjon 2006: Thor Willy Ruud Hansen, Dag Bratlid, Britt Nakstad
Versjon 2024: Claus Klingenberg, Jannicke H. Andresen, Ingrid B. Nissen, Ragnhild Støen, Kristin Brække, Astri Lang og Thor Willy Ruud Hansen
Lysbehandlingsskjema
Ved tilbakemeldinger eller spørsmål, send en mail til veiledere@barnelegeforeningen.no.










