Nyfødtveileder
10 Glukose, elektrolytter og metabolsk sykdom
10.1 Neonatal hypoglykemi
Sist faglig oppdatert: 07.07.2022
Claus Klingenberg, Anne Lee Solevåg, Astri Lang, Loes van Den Berg, Anlaug Vatne, Dag Helge Frøisland, Håvard Garberg og Anne Bærug
Her omtales:
- Hypoglykemi i de første levedøgn (0–48 timer)
- Langvarig/resistent hypoglykemi (> 48–72 timer)
Hypoglykemi I de første levedøgn (0–48 timer)
Bakgrunn
- Blodsukkeret (BS) synker etter fødselen og er vanligvis på laveste nivå ca. 2–3 timer etter fødsel.
- Hos friske fullbårne nyfødte er BS vanligvis:
- Første levedøgn > 1,7 mmol/L
- Fra andre levedøgn > 2,5 mmol/L.
- Etter 48 timer > 3,0 mmol/L
- Symptomatiske og langvarige episoder med BS < 1,1 mmol/L er assosiert med dårligere kognitiv utvikling. Gjentatte/langvarige episoder er trolig verre enn en enkeltepisode med svært lavt BS.
- Det er ellers sprik i litteraturen om BS < 1,7–2,5 mmol/L kan påvirke senere kognitiv utvikling.
- Pasienter i risikogrupper (se under) og med underliggende sykdom kan utvikle alvorlig hypoglykemi, men den underliggende sykdommen/tilstanden kan også i seg selv bidra til dårligere kognitiv utvikling på lengre sikt.
- Debuttidspunkt av hypoglykemi kan være noe ulikt avhengig av årsak:
- Ved hyperinsulinisme (spesielt barn av mødre med diabetes) oppstår oftest hypoglykemi første 6–12 levetimer eller tidligere. Hvis normale BS etter 12 timer blir det sjelden senere lavt.
- Man ser ofte tidlig debut av hypoglykemi også hos premature og veksthemmende/SGA, men spesielt hos veksthemmede/SGA kan hypoglykemien debutere senere og være langtrukken.
Årsaker til økt risiko for hypoglykemi hos nyfødte
- Begrensede glykogenlagre (spesielt premature og veksthemmede/SGA)
- Lav aktivitet av leverenzymer for glukoneogenese og glykogenolyse første 1–3 levedøgn hos fullbårne, og over enda lenger tid hos premature
- En «forbigående» hyperinsulinisme første levedøgn, med samtidig lave nivåer av ketonlegemer.
- Et høyt basalt glukoseforbruk pga relativt stor hjerne i forhold til kroppen (hjernen står for 50–70 % av glukoseforbruket de første levedøgn)
Symptomer ved hypoglykemi
Uspesifikke! Ofte asymptomatisk! Ellers kan barna ha spisevansker, irritabilitet, sitringer, kramper, hypotoni, sløvhet, takypne, apne, cyanoseanfall, bradykardi og hypotermi.
Ved symptomer som kan være forenlig med hypoglykemi bør blodsukker kontrolleres umiddelbart.
Forebygging, screening og diagnostikk av «risikobarn»
A. PÅ FØDE/BARSELAVDELING
Risikogrupper som krever blodsukker-oppfølging etter fødsel
- Alle for tidlig fødte barn født før uke 36
- Alle barn med lav fødselsvekt for alder (SGA)
Vi foreslår en pragmatisk definisjon av «SGA» som svarer til vekt mellom 2,5–10 percentil for alder:
| Forenklet SGA definisjon: | |
| GA 36 uker | FV < 2,5 kg |
| GA 37 uker | FV < 2,6 kg |
| GA 38–39 uker | FV < 2,7 kg |
| GA 40 uker | FV < 2,8 kg |
| GA 41–42 uker | FV < 2,9 kg |
- Diabetes hos mor (pregravid eller svangerskapsdiabetes)
- Stort barn (FV > 4,7 kg)
- Medikamentbruk hos mor: f.eks. metformin, betablokker, SSRI, SNRI m.fl.
- Barn med hypotermi, perinatal asfyksi, ”sykt barn” (infeksjon, RDS m.m.), erytroblastose/hemolytisk anemi, polycytemi, syndromer som kan føre til hyperinsulinisme, andre avvik som f. eks hypofysesvikt eller metabolske sykdommer.
Forebygging av hypoglykemi hos ALLE barn i risikogrupper på føde/barsel- generelt
- Tidlig og kontinuerlig hud-mot-hud kontakt, holde barnet varmt hos mor, temperaturkontroll og legge til rette for tidlig amming/mat, oppstart innen 30–60 min etter fødsel.
Forebygging av hypoglykemi hos barn født før uke 36 og/eller med lav fødselsvekt («SGA»)
Det anbefales at disse barna rett etter første amming/forsøk på amming også får tillegg av ca. 3–5 ml/kg morsmelk, bankmelk eller morsmelkerstatning. Gis på kopp/sprøyte.
- Tilleggsmating etter amming vurderes videreført hele første levedøgn, særlig hvis barnet er trett, sovner ved brystet og suger dårlig.
- Hvis barnet etter hvert suger bedre og får melk av mors bryst minst hver 3. time (eller hyppigere) og har normalt BS trenger barnet ikke videre tilleggsmating
- Man kan ev. etter amming hjelpe mor å håndmelke og gi barnet colostrum på kopp/sprøyte.
BS-screening av barn i risikogrupper på føde/barsel
Alle barn i risikogrupper skal ta første BS omtrent 30–60 minutter etter første amming/måltid, fortrinnsvis innen 2 timer etter fødsel.
Videre BS-screening:
- Premature og SGA (se definisjon over):
- BS måling før mat/amming tilsammen tre ganger i løpet av første levedøgn og minst en gang i løpet av andre levedøgn.
- Dersom BS ≥ 2,6 mmol/L i andre levedøgn, uten ekstra tiltak, kan man stoppe målinger.
- Diabetes hos mor (alle former) og/eller FV > 4,7 kg (uten erkjent diabetes hos mor):
- BS måles minst 2 ganger før mat i løpet av første 12 levetimer.
- Ved to påfølgende BS ≥ 2,0 mmol/Li første levedøgn kan man stoppe målinger.
- Hos andre «risikobarn» gjøres individuell vurdering om behov for videre kontroller etter måling av ett-1 tidlig BS.
NB! Pasientnære blodsukkerapparater som brukes på føde- barselavdelinger skal tilfredsstille ISO15197:2013 standarden. Likevel kan påliteligheten variere, avhengig av hvilket apparat man bruker. Det bør avklares lokalt om lave BS-verdier bør bekreftes med laboratoriemålinger eller målinger fra blodgass-apparat, men behandling skal ikke forsinkes og bør starte umiddelbart.
B. PÅ NYFØDTAVDELING
Forebygging av hypoglykemi og BS-screening av barn i risikogrupper på Nyfødt avdeling
- Temperaturkontroll og tidlig amming/mat.
- Premature barn og andre syke barn som innlegges og ikke kan amme skal enten ha enteral ernæring på sonde (ev. kopp), eller intravenøst hvis de ikke fordøyer tilstrekkelig.
BS-screening av barn i risikogrupper innlagt på Nyfødt avdeling
- BS bør tas innen 2–3 timer etter fødsel (ofte i forbindelse med første blodgass)
- Første 1–2 levedøgn kontrolleres BS forslagsvis 3 ganger/døgn, f.eks en 1 gang per sykepleiervakt. Ev. hyppigere hvis spesielt høy risiko (obs alvorlig fødselsasfyksi der vi tilstreber BS 2,5–5 mmol/L).
Behandling og oppfølging av hypoglykemi
A. PÅ FØDE/BARSELAVDELING (GJELDER OG NYFØDTAVDELING)
Operasjonelle definisjoner for behandlingskrevende hypoglykemi
- 0–4 levetimer: < 1,5 mmol/L
- 4–24 levetimer: < 2,0 mmol/L
- Etter 24 levetimer: < 2,6 mmol/L
Blodsukker: < 1,5 mmol/L – alltid
- Barnelege varsles umiddelbart.
- Gi Glukogel 40 % 0,5 ml/kg buccalt (se under), etterfulgt av et måltid på 5 ml/kg på kopp/sprøyte.
- Alltid innleggelse for iv behandling ved:
- BS < 1,1 mmol/L
- BS < 1,5 mmol/L til tross for Glukogel og ekstra måltid
- Symptomatisk hypoglykemi og hvis kontroll BS ikke viser bedring etter 30–60 min.
- Hvis BS ved kontroll har steget kan man vurdere om videre enteral ernæring er nok.
- BS kontroll etter 30 min
Blodsukker: 1,5–2,0 mmol/L – etter 4 timers alder
- Barnelege varsles umiddelbart.
- Gi Glukogel 40 % 0,5 ml/kg buccalt (se under), etterfulgt av et måltid på 5 ml/kg på kopp/sprøyte.
- Overflytting til Nyfødt avdeling og iv behandling må vurderes.
- Alltid innleggelse ved (i tillegg til kriterier nevnt over):
- Symptomatisk hypoglykemi og hvis kontroll BS ikke viser bedring etter 30–60 min.
- BS-kontroll etter 30–60 min.
Blodsukker: 2,0–2,5 mmol/L – etter første levedøgn.
- Ingen kliniske symptomer: La barnet amme eller gi håndmelket morsmelk på kopp. Dersom barnet ikke vil die gis morsmelkerstatning 5–10 ml/kg på kopp/sprøyte.
- Ved kliniske tegn (f.eks. sitringer) gis Glukogel 40 % 0,5 ml/kg buccalt (se under) samtidig som amming/mating intensiveres.
- BS-kontroll etter 1 time. Hvis fortsatt blodsukker 2,0–2,5 mmol/L skal barnelege kontaktes.
- Overflytting til Nyfødt avdeling hvis hyppig mat og maks 2 doser Glukogel 40 % buccalt ikke stabiliserer BS.
- Vurder kontinuerlig mat, beriket mat (se under) eller IV behandling hvis hyppig mat ikke har ønsket effekt.
Behandlingsmål hos barn som har behov for forsterket enteral eller IV behandling av hypoglykemi er BS ≥ 2,6 mmol/L. Hos barn som kun får tilskudd av morsmelkerstatning eller morsmelk på kopp kan BS 2,0–2,5 mmol/L aksepteres første levedøgn.
Enteral ernæringsbehandling ved hypoglykemi:
- Trinn 1: Gi måltider x 12 og øk maten i forhold til hva barnet tolererer, forslagsvis 5–10 ml/kg per måltid.
- Trinn 2: Ved fortsatt hypoglykemi og barnet fordøyer kan man forsterke melken ved å tilsette glukosepolymer (Resource Energipulver®/Fantomalt®). Start gjerne med 2,5 g/100 ml, mengden kan økes opp mot 5 g/100 ml
Glukogel 40 % (dextrose gel):
Buccalt administrert glukose-gel kombinert med amming/mating er i flere land etablert som førstevalg ved behandling av hypoglykemi. Randomiserte studier har vist at som behandling for hypoglykemi, reduserer glukose-gel innleggelser på Nyfødt avdeling og fremmer amming ved utskrivelse.
I Norge er Glucogel 40 % (400 mg/ml) det mest aktuelle tilgjengelige produktet. Produsenten angir at den ikke er egnet for barn under 2 år, men tilsvarende produkt med samme advarsel brukes i Sverige og i andre land. Standard dosering er 200 mg/kg = 0,5 ml/kg. Kinnslimhinnen tørkes med en steril kompress før gelen masseres inn på innsiden av et eller begge kinn. Det skal ta maks 3 min å administrere glukose-gel dosen. Dosen kan gis inntil to ganger.
B. PÅ NYFØDTAVDELING MED MULIGHET FOR IV BEHANDLING
Glukosebehov
- Basalbehov: Vanlig 4–6 mg/kg/min = 240–360 mg/kg/time = 2,4–3,6 ml/kg/t glukose 100 mg/ml hvis man ikke gir noe enteralt.
- Ved asfyksi kan glukosebehovet kortvarig øke opp til 9–15 mg/kg/min = 540–900 mg/kg/time.
PO behandling forsøkes først som angitt over
IV glukose behandling ved hypoglykemi
- Ved symptomatisk hypoglykemi og alltid ved BS < 1,1 mmol/L, samt BS < 1,5 mmol/L etter 4 timers alder til tross tiltak: Gi minibolus glukose 100 mg/ml, 2 ml/kg over 5 min, etterfulgt av vedlikeholdsinfusjon glukose 100 mg/ml, start med 3 ml/kg/t (se tabell for opptrapping, basert på svenske retningslinjer). Sjekk BS etter 1–2 timer
- Gi ny minibolus ved BS < 1,4–1,5 mmol/L til tross for iv glukose infusjon.
- Ved moderat hypoglykemi på tross av intensivert enteral behandling kan man unnlate minibolus og gå rett på vedlikeholdsinfusjon
- Hvis fortsatt hypoglykemi på tross av vedlikeholdsinfusjon (samt enteral ernæring) så trappes først raten opp og deretter glukosekonsentrasjonen (se tabell).
- Ved bruk av konsentrerte (hypertone) glukoseløsninger (>150–200 mg/ml) må man etablere en sentral tilgang (NVK/CVK).
- Ved iv behandling av hypoglykemi må man påse at infusjonen går kontinuerlig med den glukosekonsentrasjonen som er bestemt. Hvis dryppet går ut, må det startes igjen umiddelbart pga fare for raskt fall i blodsukker.
Opptrapping av iv glukose ved vedvarende hypoglykemi
| Glukosekonsentrasjon | Infusjonshastighet | Glukosetilførsel | |
| Steg I | 100 mg/ml | 3 ml/kg/time | 5,0 mg/kg/min |
| Steg II | 100 mg/ml | 4 ml/kg/time | 6,7 mg/kg/min |
| Steg III | 150 mg/ml | 4 ml/kg/time | 10 mg/kg/min |
| Steg IV | 200 mg/ml | 4 ml/kg/time | 13,3 mg/kg/min |
- Disse infusjonshastighetene gir en væskemengde tilsvarende full døgnmengde første levedøgn.
- Hvis man starter rett på vedlikeholdsinfusjon kan man ev. starte med lavere infusjonshastighet, særlig hvis barnet fordøyer godt og får enteral ernæring i tillegg.
- Uansett må væskebalanse vurderes og man må være obs med tanke på overvæsking.
- I sjeldne tilfeller ved svært alvorlige hypoglykemi tilfeller kan det være behov for enda mer konsentrerte glukoseløsninger.
Behandlingsmål ved IV behandling
BS ≥ 2,6 mmol/L første 48 timer og ≥ 3,0 mmol/L etter 48 timer.
Nedtrapping IV behandling ved hypoglykemi:
Fortsette med enteral ernæring. Opptrapping av enteral ernæring (EN) med samtidig nedtrapping av iv glukose, for å oppnå raskest mulig overgang til kun enteral ernæring. Når man beholder totalt karbohydrat inntak (EN+IV) likt ved opptrapping av EN, samt nedtrapping av IV glukose, kan man unnlate å kontrollere BS etter hvert steg. I så fall holder det med BS måling 1x/døgn til barnet klarer seg uten IV glukose og med vanlig mat og vanlige måltidsintervaller.
Nedtrapping enteral støttebehandling ved hypoglykemi
Hvis man har gjort tiltak for å få opp BS over ønsket nivå, f.eks. ved å gi måltid x 12 eller ved å tilføre glukosepolymer, kan man begynne nedtrapping av tiltak (til måltid x 8/reduksjon av glukosepolymer) etter at 2 påfølgende BS er over ønsket mål for alder. Man bør kontrollere BS før neste måltid ved endringer. Unngå om mulig endringer i behandling oftere enn 2 ganger per døgn.
Langvarig hypoglykemi (> 48–72 timer)
Indikasjon for utredning:
- Langvarig hypoglykemi (> 48–72 timer) uten en klar årsak som f.eks SGA/veksthemmet barn
- Behandlingsrefraktær hypoglykemi (utredning vurderes alltid ved glukosebehov > 10–15 mg/kg/min)
Glukosetilførsel må regnes ut, bruk f.eks. kalkulator for «glucose delivery rate» på NICU Tools.
Omfang av utredning avhenger av klinikk og kjente risikofaktorer.
Utredningsprøver tas fortrinnsvis mens barnet har BS < 2,6 mmol/L, men prøvetaking skal ikke forsinke behandling av hypoglykemien. Noter blodsukkerverdien ved prøvetaking.
Utredningen må individualiseres, og kan omfatte:
- Samtidig BS og insulinmåling. Ved alvorlig hypoglykemi skal en simultan insulinverdi være lav eller ikke målbar med mindre hypoglykemi er forårsaket av hyperinsulinisme. Insulinutskillelse er imidlertid pulsatil og insulin spaltes raskt slik at verdien i noen tilfeller kan være «falsk lav» ved hyperinsulinisme. Mål også C-peptid; den vil oftest være unormalt høy ved en hypoglykemi forårsaket av hyperinsulinisme og C-peptid er en mere «stabil» prøve enn insulin.
- Ketoner på urin stiks eller hurtigtest på ketoner (beta-hydroksybutyrat) i blod
- Anion-gap (fra blodgass)
- Laktat
- Ammoniakk
- "Binyreutredning" med kortisol
- Metabolske undersøkelser: aminosyrer og organiske syrer i urin og aminosyrer i plasma
- Frie fettsyrer (0,5 ml EDTA plasma som umiddelbart må settes på is. Sendes frosset til Avdeling for medisinsk biokjemi, OUS-Rikshospitalet)
- Hypofysesvikt (vurder UL av hjernen ved mistanke om sentral årsak/ midtlinjedefekter)?
- Medfødt infeksjon?
- Syndromer (Beckwith-Wiedemann, Sotos, Simpson-Golabi-Behmel, Kabuki, Costello, CDG etc.)?
- Ev. glukagonbelastning.
- Ev. leverbiopsi med tanke på glykogenose. Se kapittel om metabolske sykdommer.
- Genetisk diagnostikk, se også eget punkt om hyperinsulinisme lenger ned i avsnittet.
Flytskjema og tabell ved utredning av behandlingsresistent eller langvarig hypoglykemi
kilde: https://neo.barnlakarforeningen.se/2017/12/20/nytt-uppdaterat-vardprogram-hypoglykemi/
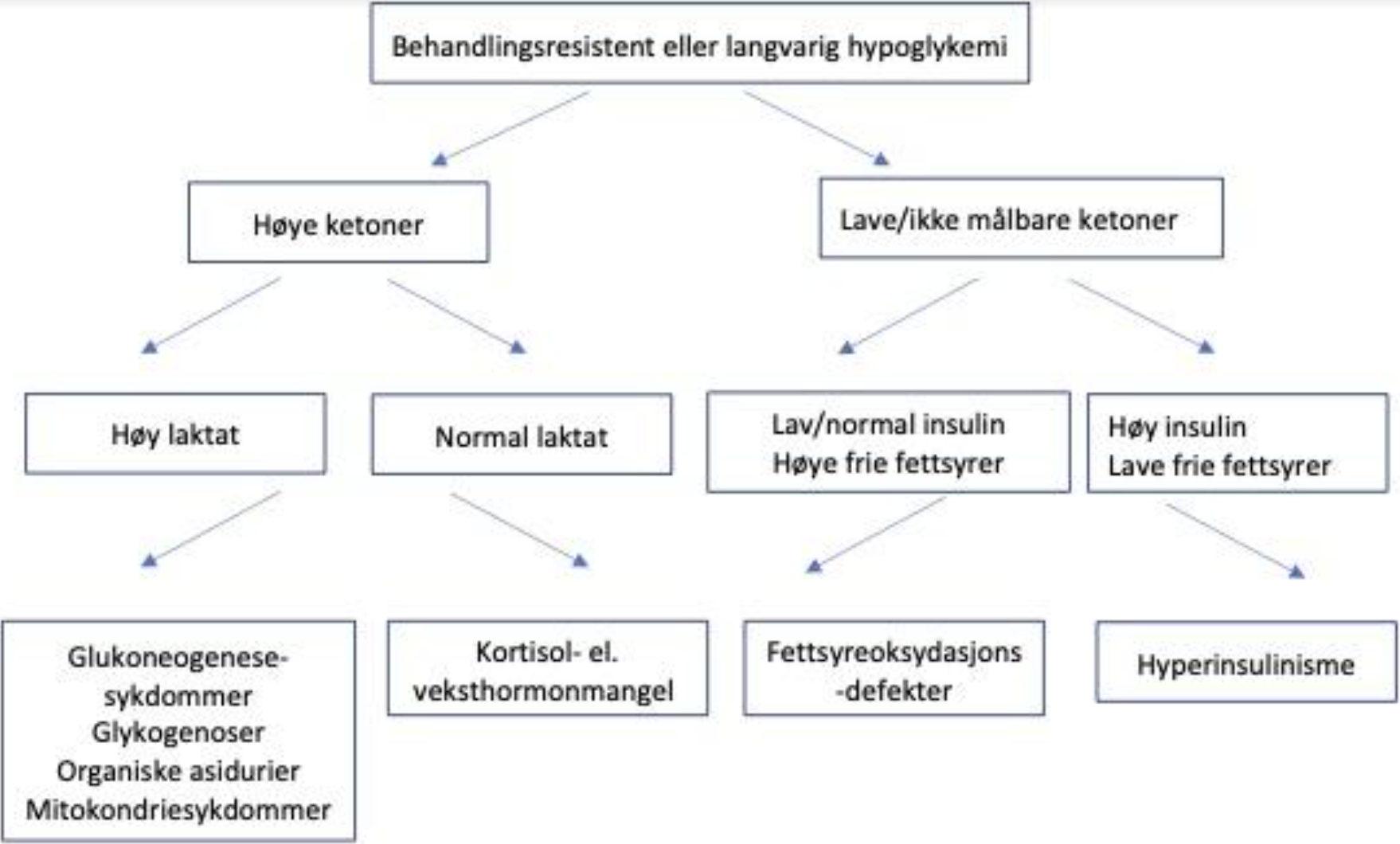
| Insulin | Ketoner (Beta-hydroksybutyrat) | Frie fettsyrer | |
| Ketotisk hypoglykemi | ↓ | ↑ | ↑ |
| Fettsyreoksydasjonsdefekt | ↓ | ↓ | ↑ |
| Hyperinsulinisme | ↑ | ↓ | ↓ |
Vedr. hyperinsulinisme
Medfødt hyperinsulinisme er karakterisert ved persisterende hypoglykemi, ofte med debut i nyfødtperioden. Adekvat utredning og behandling er viktig for å hindre at barnet får varige hjerneskader. I Norge er forekomsten trolig 2–3 pasienter årlig. Mutasjoner i flere enn 10 ulike gener kan forårsake medfødt hyperinsulinisme, og mutasjonene deles inn i to hovedgrupper:
- Mutasjoner som resulterer i defekt ATP-avhengig-kaliumkanal (KATP-kanal); kanalopati
- Mutasjoner som forårsaker forstyrret eller unormal metabolisme (intracellulær defekt)
Mutasjoner i genene som koder for sub-enheter i beta-cellens KATP-kanal (ABCC8 og KCNJ11) utgjør rundt 40–50 % av alle tilfeller med medfødt hyperinsulinisme, og gir ofte en alvorlig hypoglykemi som ikke responderer på diazoxid. Mer sjelden er mutasjoner i gener som koder for metabolske enzymer som glukokinase (GCK), glutamat dehydrogenase (GLUD1), og kortkjede-hydroksyacyl-CoA-dehydrogenase (HADH). Disse kan gi både milde og alvorlige tilfeller av medfødt hyperinsulinisme, men det er som oftest respons på diazoxid-behandling.
Histologisk deles hyperinsulinisme inn i diffus, fokal og atypisk.
Utredning er komplisert og skal forsøke skille mellom defekt i kaliumkanal versus defekt intracellulært, og skille mellom diffus versus fokal type.
- Etabler diagnosen hyperinsulinisme – se figur/tabell. Viktigst er påvisning av normale til høye insulin (C-peptid) verdier målt samtidig med lave BS-verdier. Og ingen ketoner i urin/blod.
- Start med diazoxid som vil virke ved intracellulære defekter. Manglende respons indikerer en defekt i kaliumkanal
- Gi ev. glukagon eller oktreotid
- Genetiske analyser og PET-scan (skille diffus og fokal type) er aktuelt. Ev. kirurgi.
Det anbefales kontakt med Haukeland Universitetssykehus som har spesialkompetanse på området for å diskutere både diagnostikk og behandling. Genetisk utredning av medfødt hyperinsulinisme gjøres ved Medisinsk genetisk avdeling på Haukeland sykehus, se https://genetikkportalen.no/?act=tilst&TgID=1&katID=33&TilID=578&GenID=594&ArvID=1&Visana=alle&Vise=0#gen
Ved langvarig/resistent hypoglykemi vurderes medikamentell behandling
- Glukagon: Mest aktuelt og er effektivt hvis substrattilførselen er adekvat. Særlig effektivt hos veksthemmede nyfødte. Gis enten som intermitterende injeksjoner på 0,1–0,2 mg/kg i.v/i.m eller helst som infusjon i dosering 5–20 mikrogram/kg/time (dosen justeres til ønsket BS-nivå). Kan også brukes til å stabilisere BS i akutte situasjoner ved mistenkt/påvist hyperinsulinisme.
- Hydrokortison i.v.: 10 mg/kg/24 t fordelt på 3–4 doser kan også brukes. Anbefales primært ved påvist binyrebarksvikt eller hypofysesvikt (f.eks. mistanke om septo-optisk dysplasi).
- Diazoxid (Proglycem®): 5–10 mg/kg fordelt på 3 doser. Forsøkes ved påvist hyperinsulinisme. Diazoxid kan gi væskeretensjon og risiko for utvikling av pulmonal hypertensjon. Diazoxid bør kombineres med hydroklortiazid. Diazoxid gir også økt behåring. Dosen kan økes til 20 mg/kg/d, men hvis det da ikke er effekt er pasienten «diazoxid non-responder»; og det kan indikere at det foreligger en KATP-kanal (ABCC8 og KCNJ11) mutasjon.
- Oktreotid (Sandostatin®): Undertrykker insulinutskillelsen og kan være aktuelt ved hyperinsulinisme (spesielle situasjoner). Finnes i løsninger på 50 eller 100 mikrogram/ml. Startdosering på 5 mikrogram/kg/d fordelt på 3–4 doser gitt subcutant eller som infusjon. Kan økes opp til 35 mikrogram/kg/d. Diskuter med spesialist/se spesiallitteratur.
- Sirolimus: Hemmer beta-celle proliferasjon og insulin sekresjon, og kan være aktuelt ved hyperinsulinisme. Diskuter med spesialist/se spesiallitteratur
Man gir også naturligvis peroral/enteral ernæring, ev. kontinuerlig sondeernæring etter toleranse. Varsomhet og langsom opptrapping på sonde er viktig hos barn som har betydelig risiko for NEC (dysmature < 2,5 percentilen og små premature). Melken kan etter noen dager tilsettes en glukosepolymer eller kombinert fett og karbohydrater (Duocal® 2,5 g/100 ml)
NB. Et barn som har vært behandlet for langvarig hypoglykemi (> 48–72 timers alder) bør ikke utskrives før man er sikker på at barnet kan holde normalt blodsukker ved selvregulering. Normalt BS etter 48–72 timers alder anses å være > 3,0 mmol/L.
Referanser
- Committee on Fetus and Newborn (AAP), Adamkin DH. Postnatal Glucose Homeostasis in Late-Preterm and Term Infants. Pediatrics 2011;127;575
- Stanley CA et al. Re-Evaluating “Transitional Neonatal Hypoglycemia”: Mechanism and Implications for Management. J Pediatr 2015; 166: 1520-5
- Thornton PS, et al. Recommendations from the Pediatric Endocrine Society for evaluation and management of persistent hypoglycemia in neonates, infants, and children. J Pediatr 2015; 238–245
- Tin W et al. 15 year follow-up of recurrent “hypoglycemia”: in preterm infants. Pediatrics 2012; 1497–1503.
- Kerstjens JM, et al. Neonatal morbidities and developmental delay in moderately preterm-born children. Pediatrics 2012; e265–e272
- Kaiser JR, et al. Association between transient newborn hypoglycemia and fourth-grade achievement test proficiency: a population-based study. JAMA Pediatr 2015; 913–921
- McKinlay CJD et al. Neonatal glycemia and neurodevelopmental outcomes at 2 years. N Engl J Med 2015; 1507-1518
- Kuwa K, et al. Relationships of glucose concentrations in capillary whole blood, venous whole blood and venous plasma. Clin Chim Acta 2001; 307: 187-92.
- Svenska neonatalföreningen. Nytt uppdaterat vårdprogram hypoglykemi 2017.
https://neo.barnlakarforeningen.se/2017/12/20/nytt-uppdaterat-vardprogram-hypoglykemi/ - British Association of Perinatal Medicine. Identification and Management of Neonatal Hypoglycaemia in the Full Term Infant. Framework for Practice. Revised October 2017
- Levene I, et al. Guideline review. Identification and management of neonatal hypoglycaemia in the fullterm infant (British Association of Perinatal Medicine—Framework for Practice). Arch Dis Child Educ Pract Ed 2019; 104: 29-32
- van Kempen AAMW, et al. Lower versus Traditional Treatment Threshold for Neonatal Hypoglycemia. N Engl J Med 2020; 382:534-44.
- Skjaerven R et al. Birthweight by gestational age in Norway. Acta Obstet Gynecol Scand. 2000;79;440-9.
- Weston PJ, et al. Oral dextrose gel for the treatment of hypoglycaemia in newborn infants. Cochrane Database Syst Rev. 2016; 4: CD011027.
- Edwards T, et al. Oral dextrose gel to prevent hypoglycaemia in at-risk neonates. Cochrane Database Syst Rev. 2021;5: CD012152.
- Galcheva S, et al. Diagnosis and management of hyperinsulinaemic hypoglycaemia. Best Pract Res Clin Endocrinol Metab 2018; 32: 551-73
Publisert 2019: Claus Klingenberg og A Leknessund










