Nyfødtveileder
6 Hjerte og sirkulasjon
6.2 Hypotensjon og hypoperfusjon
Sist faglig oppdatert: 14.01.2025
Claus Klingenberg, Lene Nymo Trulsen, Astri Lang og Jannicke H. Andresen
Bakgrunn
Måling og vurdering av sirkulasjonssvikt hos nyfødte
Prinsipielt vil lavt blodtrykk/hypoperfusjon kunne være forårsaket av forstyrrelser i hjertemuskelens pumpeevne (kontraktilitet), endringer i sirkulerende blodvolum, hjertets fylningsgrad i diastole og tonus/integriteten til det perifere karsystemet (vasokonstriksjon/vasodilatasjon).
Husk at BT kun er en ”surrogatmarkør” på systemisk sirkulasjon/perfusjon: BT = systemsirkulasjon (flow) x systemisk vaskulær motstand (SVR).
- BT kan være normalt eller høyt hvis SVR er høy, selv om systemsirkulasjon/cardiac output er lav.
- Det er holdepunkter for at SVR er den viktigste determinanten for BT i overgangsfasen fra føtal til nyfødt sirkulasjon og at det i denne fasen er relativt dårlig korrelasjon mellom BT og systemisk sirkulasjon.
- Vurder derfor alltid også diurese og perifer sirkulasjon (klinikk/laktat/kapillær fylningstid).
- Vurder alltid også diastoliske og systoliske trykk, disse gir viktig informasjon om patofysiologien bak det lave middelblodtrykket.
Preload, afterload og kontraktilitet er viktige momenter i BT-vurdering
- Preload = Mengden blod som finnes i ventrikkelen i endediastole
- Afterload = Motstanden som ventrikkelen jobber mot
- Kontraktilitet = Myokardets evne til å trekke seg sammen
Preload, afterload og kontraktilitet bestemmer slagvolumet (SV).
SV x hjertefrekvens = Hjerteminuttvolum/«cardiac output».
Diagnostikk og utredning
Her nevnes noen elementer i diagnostikk som brukes til å vurdere sirkulasjon/perfusjon.
Blodtrykk
Ved klinisk mistanke om sirkulasjonssvikt/svært syke nyfødte bør blodtrykk (BT) fortrinnsvis måles invasivt (NAK/PAK). Se både på systolisk og diastolisk trykk - ikke kun middel trykk!
Vedrørende måling av blodtrykk
- Sjekk alltid at sensor er kalibrert skikkelig før man godtar at BT er lavt og før man starter behandling. Særlig hvis andre forhold tilsier god perfusjon.
- Middelarterie BT: En tommelfingerregel (uten godt vitenskapelig grunnlag) har lenge vært at man i første 1.–2. levedøgn ønsker å holde middeltrykket lik eller høyere enn GA i antall uker. For de minste kan man likevel godta lavere verdier første 12 timer forutsatt tilfredsstillende perifer sirkulasjon. BT stiger i løpet av de første dagene og vil som regel selv hos de minste premature være over 30 mmHg i middeltrykk etter 3 døgn.
- Diastolisk BT (DBT): Dette er bestemmende for koronarperfusjon, og det kan være hensiktsmessig å holde DBT > 3 percentilen, se tabell under. Om dette er relevant de første levedøgnene er usikkert, men som en tommelfingerregel bør DBT holdes over 3 percentilen.
Årsaker til lavt systolisk BT (SBT)
- Pumpesvikt (redusert myokardfunksjon)
- Hypovolemi (lav preload)
- Etter blødning eller annet væsketap
- Relativ pga. respiratorbehandling/high flow oksygen terapi (HFO) med høye trykk
- Relativ pga. persisterende pulmonal hypertensjon (PPHN) (dårlig fylning av venstre ventrikkel)
- Relativ pga. kardiell tamponade
- Adaptasjonsforstyrrelse
- Avnavling og forhøyet afterload (mest aktuelt hos premature)
- Post ligation cardiac syndrome (PLCS), kan oppstå etter kirurgisk PDA lukking
- Vasokonstriksjon (høy afterload)
- Kald sepsis
Årsaker til lavt diastolisk BT (DBT)
- Forstørret karseng
- Signifikant PDA med "steal" av blodflow fra aorta til pulmonalkretsløpet (reversering av flow i aorta i diastolen)
- AV-malformasjoner
- Store hemangiomer (for eksempel i lever)
- Vasodilatasjon (lav afterload)
- Varm sepsis
- Nekrotiserende enterocolitt (NEC)
- Medikamenter som benzodiazepiner, fenemal
- Hypovolemi (lav preload)
Ekkokardiografi
Bør utføres raskt ved hypotensjon som ikke svarer på et volumstøt (hjertefeil? ductus? ventrikkelfunksjon? tamponade? osv.). Ekkokardiografi gir informasjon om sirkulatoriske forhold og volumstatus.
Ekkokardiografi vil kunne bidra til å avklare:
- Pumpesvikt/nedsatt kontraktilitet ev. kombinert med økt perifer motstand
- Vurder forkortningsfraksjon (obs. påvirkes av preload) og cardiac output som måles i høyre utløpstraktus når ductus er åpen (normalt 150–300 ml/kg/min)
- Patologisk vasodilatasjon (f.eks. ved sepsis), men relativt god kontraktilitet
- Cardiac output er normalt eller økt. Ofte forhøyet pulstrykk
- En stor V-H shunt for eksempel pga. en stor PDA.
- Volumstatus
Figur 1: Middelarterie BT første 3 levedøgn (Clin Perinatol 1999; 26:981–96). Grafen viser 10 percentilen relatert til GA.
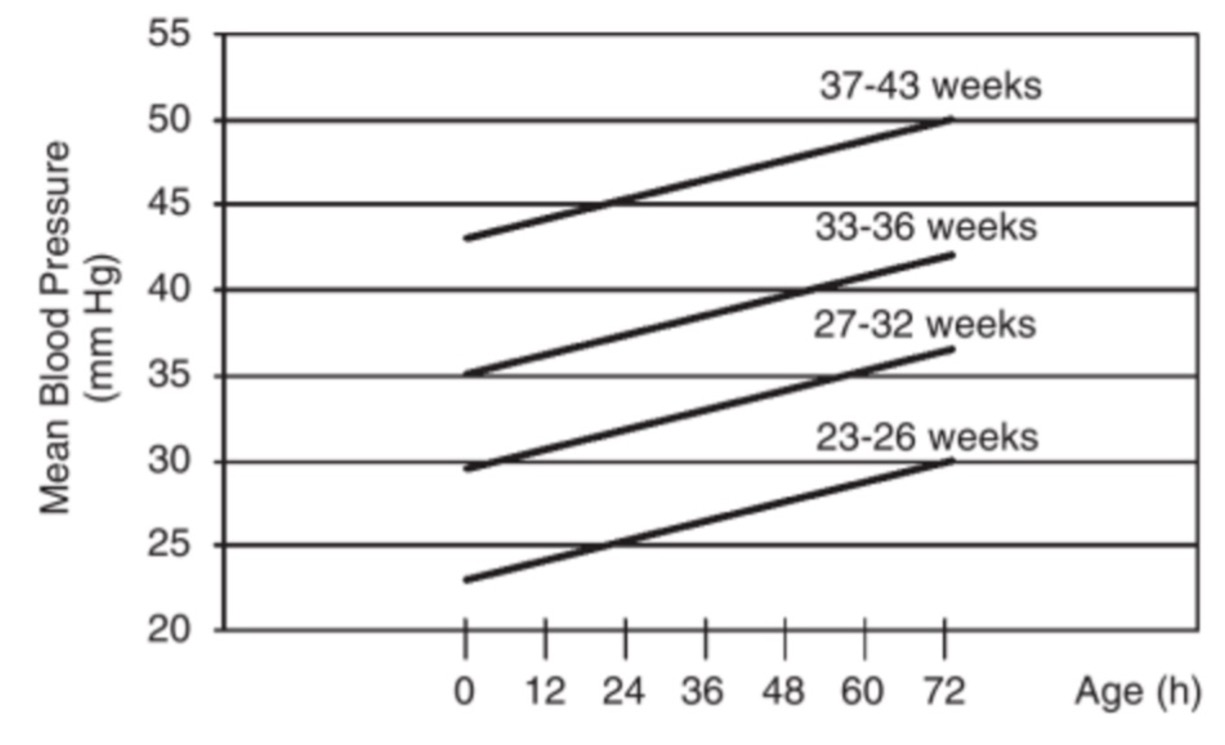
Tabell 1: 3 percentil for systolisk, diastolisk og middelblodtrykk i henhold til GA.
Giesinger et al 2016.
| GA (uker) | Systolisk (mmHg) | Middel (mmHg) | Diastolisk (mmHg) |
| 24 | 32 | 26 | 15 |
| 25 | 34 | 26 | 16 |
| 26 | 36 | 27 | 17 |
| 27 | 38 | 27 | 17 |
| 28 | 40 | 28 | 18 |
| 29 | 42 | 28 | 19 |
| 30 | 43 | 29 | 20 |
| 31 | 45 | 30 | 20 |
| 32 | 46 | 30 | 21 |
| 33 | 47 | 30 | 22 |
| 34 | 48 | 31 | 23 |
| 35 | 49 | 32 | 24 |
| 36 | 50 | 32 | 25 |
Troponin T (TnT)
Spesielt aktuelt å ta ved asfyksi og redusert myokardfunksjon. TnT reflekterer myokardaffeksjon/-iskemi, dog usikker klinisk verdi. Referanseområder er ennå ikke helt klarlagt hos nyfødte og avhengig av analysemetode. Som en grov tommelfinger regel kan man anse at TnT verdier > 100 nanogram/L hos fullbårne og verdier > 200 nanogram/L hos premature gir holdepunkter for myokardiskemi. Troponin I er ikke fullt uttrykket før fosteret er 9 md. gammel, dvs. ikke egnet til bruk hos premature.
Mulige årsaker til forhøyet TnT
- Perinatal asfyksi
- Redusert koronarperfusjon (f.eks. ved alvorlig respiratorisk distress syndrom (RDS) og asfyksi med PPHN)
- Myokardskade pga. avvikende koronaranatomi (ALCAPA)
Laktat
Et mål på perifer sirkulasjon (bedre enn BE). Laktat-verdier > 2,5 mmol/L anses å være forhøyet og laktatverdier > 4–5 mmol/L klart forhøyet. Kapillære prøver korrelerer godt med arterielle prøver.
Obs: Laktat kan være forhøyet av andre årsaker enn anaerob metabolisme (f.eks. ved rask glukoseinfusjon, beta-adrenerge medikamenter, alkalose, stress/smerte, hos small for gestational age (SGA)-barn tross normoksemi og sjelden pga. metabolsk sykdom). Kan være viktig å følge hos barn med hjertefeil før/etter operasjon.
Urinproduksjon
Oliguri = diurese < 0,5–1 ml/kg/time (etter 24 timers alder). Legg ev. inn blærekateter hos barn med behov for pressorbehandling.
Kapillær fylningstid
Måles best ved å trykke over sternum. Verdier > 3 sek anses som patologisk.
NB! Kapillær fylningstid har noe usikker verdi hos nyfødte på grunn av høy hematokrit!
En kombinasjon av kapillær fylningstid > 4 s og laktat > 4 mmol/L gir holdepunkter for dårlig systemisk sirkulasjon.
Behandling
Vedvarende BT under grensene angitt over kombinert med andre tegn/funn som taler for nedsatt perifer sirkulasjon (vurdert med ekkokardiograf, diurese, blodgass, kapillær fylningstid) er grunnlag for behandling.
- Tilbakeholden med behandling på grunnlag av BT-verdiene alene. Behandling må individualiseres ut ifra patofysiologisk årsak.
- Husk at flere aktuelle medikamenter (spesielt dopamin og adrenalin) også øker lungekarmotstanden slik at de har en uheldig innvirkning hvis barnet også har PPHN.
- Ved lave diastoliske BT vil man helst bruke vasopressorer (som øker systemisk vaskulær motstand; SVR) mens ved lave systoliske BT vil man helst bruke inotrope medikamenter (som øker slagvolum; SV), se figur under.
Figur 2: Effekter av forskjellige blodtrykksmedisiner på systemisk vaskulær motstand (SVR), lungevaskulær motstand (PVR) og slagvolum (SV).

Volumerstatning og elektrolytter
- Gi 10 ml/kg NaCl 9 mg/ml, Ringer eller Plasmalyte over 20–60 min (for valg av løsning se under). Kan gjentas. Husk at hos premature er gjentatte volum-støt omstridt, fordi hypovolemi angis å være en sjelden årsak til hypotensjon, og volum kan potensielt være skadelig, slik at det sjelden bør gis mer enn en gang.
- Ved hypovolemiske tilstander vil på den annen side volumstøt være kausal behandling.
- Ved blødning gis SAGM 10–15 ml/kg.
- Ferskfrosset plasma kan være aktuelt ved patologiske koagulasjonsparametre.
- Ved akutt behov for mere enn 2 SAGM transfusjoner bør man vurdere å gi neste transfusjon som SAGM/plasma/trombocytter i forholdet 2:2:1. Man bør da også gi kalsium da blod fra blodbanken fører til hypokalsemi pga. EDTA-innholdet.
- Hypokalsemi bør korrigeres, da normale kalsiumverdier kan bidra til å stabilisere myokard.
Tabell 2. Elektrolyttinnhold i ulike krystalloider.
| Innhold, mmol/L | NaCl 9 mg/ml | Ringer acetat | Plasmalyte® |
| Natrium | 154 | 130 | 140 |
| Kalium | - | 4 | 5 |
| Klor | 154 | 110 | 98 |
| Magnesium | - | 1 | 1,5 |
| Kalsium | - | 2 | - |
| Acetat | - | 30 | 27 |
| Glukonat | - | - | 23 |
| Osmolalitet (mosmol/L) | 290–308 | 277 | 295 |
| pH | 4,5–7 | 5–6 | 6,5–8 |
Valg av krystalloider: Noen studier på voksne og større barn har vist fordeler med væskebolus med balanserte/bufrede krystalloider (Ringer og Plasmalyte), mens andre store studier ikke har vist slike fordeler fremfor bruk av NaCl. Det er ikke gjort gode studier på nyfødte. Bufrede krystalloider kan redusere risiko for hyperklorem acidose, og inneholder en liten mengde acetat som omdannes til bikarbonat. Ringer har en lavere Na-konsentrasjon enn Plasmalyte og NaCl 9 mg/ml, og kan forverre en allerede foreliggende hyponatremi. Hos et nyfødt barn (rett etter fødsel) vil NaCl være et godt førstevalg for bolus. Hos inneliggende nyfødte kan man vurdere syre-base- og elektrolyttstatus ved valg av løsning.
PDA med stor V-H shunt som årsak til hypotensjon?
Hvis barnet er på respirator kan det være logisk å øke PEEP for å øke lungekarmotstanden og derved redusere en stor V-H shunt over en PDA. Vurdere medikamentell lukking av PDA. Unngå bruk av vasopressor for å bedre diastolisk BT, da dette vil kunne forverre en hypoperfusjon av postduktale organer (tarm, nyrer, binyrer osv.).
Inotrope/vasoaktive medikamenter og hydrokortison - tips
- Valg av medikament er avhengig av patofysiologisk årsak til hypotensjon/nedsatt systemperfusjon, systoliske og diastoliske BT verdier og klinisk skjønn.
- Sentral/kardial effekt av dopamin og dobutamin er relativt lik, men muligens gir dobutamin større økning i cardiac output enn dopamin, selv i doser < 10 mikrogram/kg/min. Dobutamin gir også en potensiell vasodilatasjon.
- I første levedøgn hos premature er det holdepunkter for at dobutamin bør være førstevalg hvis man ønsker å bedre systemsirkulasjon, både da det øker inotropi og fordi det potensielt reduserer afterload.
- Dopamin har en potent vasokonstriktiv effekt i lungekarsengen, og høye doser bør derfor unngås ved PPHN.
- Dobutamin har ingen effekt på lungekarsengen.
- Noen foretrekker bruk av lavdose-adrenalin som første inotrope medikament ved behandling av hypotensjon. Da beholder man beta-adrenerg effekt initialt uten en for kraftig vasokonstriksjon.
- Noradrenalin (NA) gir meget potent vasokonstriksjon, noe som kan være gunstig i en situasjon med perifer vasodilatasjon der man ofte ser lave diastoliske BT.
- I situasjoner med pressorbehov er det hensiktsmessig å starte hydrokortison når man får behov for mer enn 1 vasopressor/inotropikum, da det er vist at hydrokortison øker BT ved «vasopressor-resistent» hypotensjon.
Det bør gjøres en ekkokardiografisk vurdering av kontraktilitet og cardiac output før man setter inn potente pressorer, samt etter oppstart for å bedømme effekten.
Vasoaktive medikamenter og hydrokortison
Alle vasoaktive legemidler nevnt under bør fortrinns administreres i sentral vene pga. risiko for vasokonstriksjon. Hvis initialt gitt perifert bør innstikksted/ekstremitet observeres tett.
Dopamin
- Lav dose: 1–5 mikrogram/kg/min. Virker på D- og β-reseptorer.
- Moderat dose: 5–10 mikrogram/kg/min. Virker på α-, β1- og β2-reseptorer
- Høy dose: 10–20 mikrogram/kg/min. Virker mest α-reseptorer (vasokonstriksjon)
Max dose 10 mikrogram/kg/min hos premature, men gis i doser opp mot 20 mikrogram/kg/min i situasjoner med lav perifer motstand (f.eks. sepsis).
”Vanlig” dosering er 5–10 mikrogram/kg/min. Ved ”behov” > 10 mikrogram/kg/min, og vurder tillegg dobutamin.
Dopamin erstattes ofte med adrenalin som har en lignende virkningsprofil.
Dobutamin
Virker mest på β1-reseptorer. Øker cardiac output, men gir ikke vasokonstriksjon (kan ofte gi en lett vasodilatasjon pga. en direkte effekt på blodårene og ved å redusere sympatisk kartonus). Har mindre blodtrykkstigende virkning enn dopamin.
- ”Vanlig” dosering 5–15(20) mikrogram/kg/min.
Ved manglende effekt av dopamin i dose på 10 mikrogram/kg/min, kan det være aktuelt å legge til dobutamin 5–10 mikrogram/kg/min. Kan gis i samme intravenøse tilgang. Ved enkelte medfødte hjertefeil (HLHS) vil en liten dose dobutamin eller milrinon være førstevalg for å bedre systemisk perfusjon.
Adrenalin
Stimulerer α1-, α2-, β1 og β2-reseptorer. Medfører økt hjertefrekvens og økt myokardial kontraktilitet.
- Lav dose: 0,02–0,1 (0,2) mikrogram/kg/min.
- Høy dose: 0,2–0,5 mikrogram/kg/min.
I lave doser har adrenalin positiv inotrop effekt, høye doser vil gi perifer vasokonstriksjon/økt systemvaskulær motstand. Doser > 0,1 mikrogram/kg/min gir ofte økte metabolske bivirkninger, med laktacidose og hyperglykemi pga. direkte effekter på skjelettmuskel og lever. Laktacidosen kan ikke brukes som et mål på vevsiskemi og skal ikke bufres.
Noradrenalin
Stimulerer fortrinnsvis α1-, og i mindre grad α2- og β1-reseptorer, har liten effekt på β2-reseptorer. Har lite effekt på hjertet, men en sterk vasokonstringerende effekt.
- ”Vanlig” dosering 0,1–1,0 mikrogram/kg/min.
Brukes ved alvorlig hypotensjon og perifer vasodilatasjon som man f.eks. ser ved septisk sjokk. Gir en meget potent perifer vasokonstriksjon som kan være uheldig ved redusert myokardfunksjon. Det bør kun brukes ved hypotensive tilstander hvor det er god cardiac output og uttalt perifer vasodilatasjon som f.eks. ved alvorlig "varm" sepsis.
Milrinon
Selektiv fosfodiesterase-3 hemmer. Øker cardiac output ved å bedre myokardial kontraktilitet, bedrer diastolisk funksjon og reduserer vaskulær motstand. Kan virke vasodilaterende, også i lungekarsengen. I motsetning til katekolaminer gir milrinon ikke økt myokardialt O2-forbruk.
- ”Vanlig” dosering: Start med kontinuerlig vedlikeholdsinfusjon 0,30 mikrogram/kg/min. Kan økes til 0,50 og ev. 0,75 mikrogram/kg/min. Lavest dose hos premature.
NB. Milrinon kan gi et BT-fall hvis man gir ladningsdose, noe som derfor ikke anbefales. Milrinon skal generelt først gis etter at volumstatus er sikret (monitorer), og kombineres ofte med adrenalin for ytterligere inotropi ved hjertesvikt, og ved PPHN for å forebygge BT-fall. Adrenalin startes da opp først. Milrinon brukes blant annet en del ved PPHN og etter ductus-/hjertekirurgi. Det ser imidlertid ikke ut til å kunne forebygge lav systemisk sirkulasjon i første levedøgn hos premature.
Vasopressin
Brukes primært ved katekolamin-resistent hypotensjon, ved ønske om potent afterload heving. Effekt på V1 (kar) og V2 (nyrer) reseptor og gir økt kartonus, vasokonstriksjon og økt sirkulerende blodvolum. Gir økt frisettelse av kortison. OBS. Perifer sirkulasjon (sjekk fingre og tær). Kan virke negativt på mesenterialsirkulasjonen og unngås ved NEC.
- Startdose i utgangspunktet rundt 0,02–0,03 U/kg/time, men er beskrevet brukt i doser helt opp til 0,12 U/kg/time uten økt forekomst av bivirkninger.
Kan være et godt alternativ ved hypotensjon ved PPHN da vasopressin i liten grad påvirker lungekarmotstand, men bedrer diastolisk hypotensjon. Forsiktighet ved venstre ventrikkel pumpesvikt.
Standardkonsentrasjon: 0,1 U/ml.
Hydrokortison
Hydrokortison i lave doser er vist å gi blodtrykksstigning innen 2 timer som ofte etterfølges av en stabilisering av kardiovaskulær status. Årsaker:
- Tidlig, non-genomisk effekt: Nedsatt noradrenalin "re-uptake", nedsatt prostacyklin produksjon, nedsatt patologisk vasodilatasjon og bedret kapillær integritet.
- Sen, genomisk effekt: Oppregulering av adrenerge reseptorer som ofte er nedregulert hos kritisk syke eller ved langvarig bruk av høye doser adrenerge medikamenter.
- Substitusjons-behandling: Syke premature kan ha en relativ binyrebarksvikt. HK-behandling vil da være logisk som substitusjonsbehandling.
Det er vist at halveringstiden for HK er lenger hos nyfødte enn hos voksne, og spesielt lang hos ekstremt premature. En stor randomisert studie av ekstremt premature viste en effekt av dosering hydrokortison 0,5 mg/kg x 2 i første leveuke i form av redusert bronkopulmonal dysplasi (BPD), samt også høyere BT enn i placebogruppen. Enda høyere doser av HK i første leveuke har imidlertid vært assosiert med bivirkninger både på kort sikt (GI perforasjon) og lang sikt (mulig påvirket nevrologisk funksjon).
Watterberg foreslår følgende dosering av hydrokortison ved hypotensjon:
Første dose 1 mg/kg. Vurdere effekt på BT innen 2–4 timer, hvis ingen effekt har det neppe noen hensikt å fortsette hydrokortison behandlingen. Hvis det har effekt kan man fortsette med 0,5 mg/kg x 2 hos de mest umodne (f.eks. GA < 28–30 uker) og 0,5 mg/kg x 3 hos mer modne og fullbårne.
Hvis effekten på BT avtar kan man forsøke en ny dose på 1 mg/kg. En kumulativ hydrokortison-dose på 8,5 mg/kg over en 10 dagers periode syntes trygt hos ekstremt premature, og generelt bør man unngå høyere kumulativ dose/langvarig eksponering.
NB. Serum kortisol er vanskelig å vurdere da i) total serum-kortisol måles, mens det kun er den frie fraksjonen som er aktiv, ii) det er pulsatil sekresjon av kortisol slik at verdier kan variere, og iii) høye verdier kan ev. skyldes manglende metabolisme/eliminasjon hos kritisk syke. Det frarådes derfor å måle dette rutinemessig.
Flytskjema for behandling av hypoperfusjon og hypertensjon
Utarbeidet på OUS.
Følgende flytskjemaer kan benyttes som utgangpunkt for oppstart av blodtrykkstøttende behandling i gitte kliniske scenarier;
- Premature (spesielt GA < 28 uker)
- Terminbarn (NB ikke PPHN eller ved terapeutisk hypotermibehandling)
- Pulmonal hypertensjon (PPHN)
- Septisk sjokk hos nyfødte
- Hypotensjon ved terapeutisk hypotermibehandling
1. Premature (spesielt GA < 28 uker)

*Dopamin og adrenalin sidestilles, hvis dopamin velges først er adrenalin neste valg etter hydrokortison.
2. Terminbarn (ikke PPHN eller HIE med terapeutisk hypotermi)
.jpg)
*Dopamin og adrenalin sidestilles, hvis dopamin velges først er adrenalin neste valg etter hydrokortison.
3. Pulmonal hypertensjon (PPHN)*
.jpg)
*Ved PPHN er ekkokardiografi med kontraktilitetsvurdering essensielt tidlig i forløpet, og underveis.
4. Septisk sjokk
Kaldt septisk sjokk: Behandles etter vanlige retningslinjer for hypotensjon for hhv. premature eller terminbarn (flytskjema 1 og 2).
Varmt septisk sjokk: følger flytskjema under:
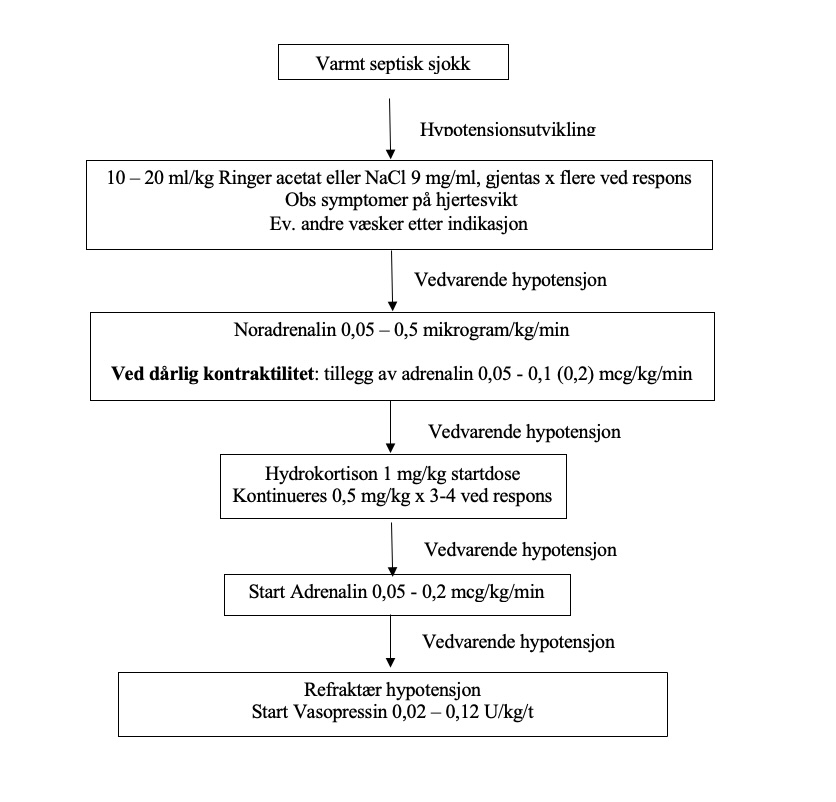
5. Hypoksisk iskemisk encefalopati (HIE) med terapeutisk hypotermi
%20med%20terapeutisk%20hypotermi.jpg)
#Høyere doser adrenalin og vasopressin er kontraindisert ved pumpesvikt, da disse øker afterload kraftig og vil forverre pumpesvikten.
Ved tegn til PPHN byttes det over til flowskjema for PPHN.
Sentrale referanser
- Mullaly R, et al. Haemodynamic assessment and management of hypotension in the preterm. Arch Dis Child Fetal Neonatal Ed 2024; 109:120-7.
- El-Khuffash A, et al. Hemodynamic Assessment and Monitoring of Premature Infants. Clin Perinatol 2017; 44:377-93.
- Kumbhat N, et al. Corticosteroids for Neonatal Hypotension. Clin Perinatol. 2020; 47:549-62.
- Hammond DA, et al. Efficacy and Safety of the Early Addition of Vasopressin to Norepinephrine in Septic Shock. Journal of Intensive Care Medicine. 2017; 1-7
- Wu TW, et al. Recognition and management of neonatal hemodynamic compromise. Pediatrics and Neonatology. 2021; 62: S22eS29
- Rodriguez MJ, et al. Cerebral blod flow velocity and oxygenation correlate predominantly with right ventricular function in cooled neonates with moderate-severe hypoxic-ishcemic encephalopathy. 2020; 179:1609-18.
- McNamara P, et al. Dopamine and Neonatal Pulmonary Hypertension - Pressing Need for a Better Pressor 2022; 246:242-50.
- Evans N. Which inotrope for which baby? Arch Dis Child Fetal Neonatal Ed. 2006; 91: F213-20. Review.
- Davis AL, et al. American College of Critical Care Medicine Clinical Practice Parameters for Hemodynamic Support of Pediatric and Neonatal Septic Shock. Crit Care Med. 2017; 45(6):1061-93
- Mengwei N, et al. Use of Vasopressin in Neonatal intensive care unit patients with hypotension. J Pediatr Pharmacol Ther 2017; 22:430-5.
- Barrington KJ, et al. Treating hypotension in extremely preterm infants. The pressure is mounting. Arch Dis Child Fetal Neonatal Ed 2016; 101:F188-9.
- Watterberg KL, Hydrocortisone Dosing for Hypotension in Newborn Infants: Less Is More. J Pediatr 2016; 174:23-6
- Peebles ES, An evaluation of hydrocortisone dosing for neonatal refractory hypotension. J Perinatol. 2017; 37:943-6.
- Motta M, et al. Fresh Frozen Plasma Administration in the Neonatal Intensive Care Unit: Evidence-Based Guidelines. Clin Perinatol 2015; 42:639-50-
- Rios DR, et al. Trends in pharmacotherapy for neonatal hypotension. J Pediatr 2014; 165:697-701.
- Rios DR, et al. Vasopressin versus Dopamine for Treatment of Hypotension in Extremely Low Birth Weight Infants: A Randomized, Blinded Pilot Study. J Pediatr 2015; 166:850-5.
- Giesinger R, et al. Hemodynamic instability in the critically ill neonate: An approach to cardiovascular support based on disease pathophysiology. Seminars in Perinatology. 2016; 40:174-88.
- Budniok T, et al. Effect of Vasopressin on Systemic and Pulmonary Hemodynamics in Neonates. Am J Perinatol 2021; 38:1330-4.
Tidligere versjoner
2022: Claus Klingenberg, Per Ivar Kaaresen, Lene Nymo Trulsen, Jannicke H Andresen










