Nyfødtveileder
9 Nevrologi, sanser og mishandling
9.14 Neonatalt abstinens syndrom og antidepressiva/antipsykotika i svangerskap
Sist faglig oppdatert: 01.01.2021
Claus Klingenberg og Jannicke H. Andresen
Bakgrunn
Neonatalt abstinens syndrom (NAS) er et begrep som dekker de symptomer som nyfødte barn av rusmiddelbrukere kan få. Det kliniske bildet er vanligvis dominert av CNS irritabilitet/forstyrrelse, gastrointestinale forstyrrelser, respiratoriske forstyrrelser og autonome symptomer. Barna har vanligvis lavere fødselsvekt enn forventet (obs. SGA barn) og økt vekttap i nyfødtperioden.
NB: Andre årsaker til lignende symptomer, som f.eks asfyksi, sepsis, metabolsk sykdom, hypoglykemi, hypokalsemi, RDS o.l., må alltid utelukkes.
Årsaker/etiologi:
- Mødre som er under legemiddel-assistert rehabilitering (LAR) med metadon/buprenorfin i høye døgndoser; ofte 50–100 mg metadon og 8–16 mg buprenorfin. NB bruk av buprenorfin er i noen studier assosiert med lavere forekomst og kortere varighet av NAS-symptomer enn bruk av metadon. Buprenorfin brukes også i økende grad sammen med nalokson. Det blir født mellom 30 og 50 barn årlig i Norge av mødre i LAR-behandling og hvor fosteret dermed har vært eksponert for metadon eller buprenorfin i fosterlivet.
- Misbruk av narkotiske stoffer, alkohol eller legemidler med misbrukspotensiale (legemidler som inneholder f.eks opioider, benzodiazepiner, barbiturater)
- Konvensjonell bruk av legemidler som påvirker hjernen (obs. antidepressiva/antipsykotika), omtales nærmere i eget avsnitt.
Kjente stoffer som kan gi NAS: Opioider og benzodiazepiner (brukes begge mye), og barbiturater (brukes lite).
Man har ikke funnet et klart definert NAS ved intrauterin eksponering for sentralstimulerende stoffer (kokain, PCP/PCP-lignende stoffer som ketamin, amfetamin og amfetaminlignende stoffer som ecstasy). De symptomer man ser hos noen nyfødte (ofte første 2–3. levedøgn) kan snarere være uttrykk for en direkte effekt av sentralstimulerende medikamenter enn abstinens. Det synes dog som om kombinasjon av kokain og opioider kan forsterke symptomer på NAS.
Intrauterin eksponering for cannabis synes ikke å gi NAS, men kan ha uheldig innvirkning på senere adferd og nevropsykologisk utvikling.
Vedr. antidepressiva og antpsykotika; se eget avsnitt lenger ned.
Årsaken til symptomene ved NAS
I den perioden barnet må venne seg til fravær av det rusmiddel som ble tilført intrauterint oppstår en såkalt CNS hyperarousal hos barnet. Symptomene kan variere noe med hvilket rusmiddel som er inntatt, men noen misbrukere inntar flere rusmidler samtidig.
I dette avsnittet vil en først omtale NAS (primært utløst av opioider) deretter kort omtale andre medikamenter som kan påvirke foster/nyfødte (oftere i mildere grad).
Neonatalt abstinenssyndrom
Symptomer og klinikk ved NAS (primært utløst av opioid-abstinens)
CNS irritabilitet/forstyrrelser
- Høyfrekvent og/eller langvarig skriking
- Forstyrret søvn (korte intervaller med søvn mellom måltidene)
- Sitringer/skjelvinger
- Økt muskeltonus
- Hudirritasjon pga. gnissing (spes. knær/albuer)
- Myoklonier og ev. kramper
- Lyd- og lysskyhet
- Økt Moro refleks
Gastrointestinal forstyrrelser
- Økt suging, men dårlig koordinasjon fører til nedsatt matinntak
- Økt gulping/brekninger, ev. oppkast
- Hyppige løse/vandige avføringer
Respiratoriske forstyrrelser og autonome symptomer
- Økt respirasjonsfrekvens, ev. nesevingespill og inndragninger (DD: RDS)
- Nesetetthet
- Nysing (> 3–4 ganger av gangen)
- Gjesping (> 3–4 ganger av gangen)
- Svetting
- Feber
- Marmorert hud
Start og varighet av symptomer
Symptomer starter vanligvis i løpet av første 24–48 levetimer, men kan komme først etter flere (opptil 5–10) dager, avhengig av hvilke(t) stoff(er) som er inntatt, tidspunktet for siste inntak og stoffenes farmakokinetikk. Varigheten av symptomene kan være opptil 6 mnd. (”forsinket abstinens syndrom”/rusrelatert funksjonsforstyrrelse). Ved alkoholmisbruk kan barnet også få føtalt alkoholsyndrom (FAS).
Eksempel på start og varighet av symptomer for enkelte stoffer.
| STOFF | START | TOPP | VARIGHET | ALVORLIGHETSGRAD |
| Heroin | 0–3. levedag | 3.–7. døgn | 2–4 uker | Mild → moderat |
| Metadon | 0–5. levedag | 7.–10.døgn | 2–4 mnd | Mild → alvorlig |
| Buprenorfin | 0–3. levedag | 3.–7. døgn | 2–4 uker | Mild → alvorlig |
| Kodein | 0–1. levedag | 2.–4. døgn | 1–3 uker | Mild → moderat |
| Benzodiazepiner | 0–12. levedag | 2–8 uker | Mild → moderat | |
| Barbiturater | 1–14. levedag | 4–6 mnd | Moderat → alvorlig | |
| Kokain* | 0–3. levedag | 3.–5. døgn | 2–8 uker | Mild → moderat |
| PCP/ketamin* | 0–2. levedag | 5.–7. døgn | 2–6 mnd | Moderat → alvorlig |
| Amfetamin* | 0–3. levedag | 3.–5. døgn | 2–8 uker | Mild → moderat |
* Symptomer skyldes trolig heller direkte effekt av disse stoffene enn abstinens
Diagnostikk og utredning
Ved mistanke om NAS, nøyaktig anamnese på rusmiddelbruk under svangerskapet. For korrekt fortolkning av rusmiddelanalyse er det også viktig å vite hvilke medikamenter som ble gitt i forbindelse med fødsel.
Vanlig klinisk status
- Ev. symptomer på NAS? Bruk skårings-skjema!
- Barnet overflyttes fra barsel/føden til Nyfødt intensiv kun ved symptomer eller hvis det er stor mistanke om at barnet kan utvikle NAS.
Aktuelle blodprøver
Ved innkomst hb, hvite, tr.cyt, CRP, glukose, SBS med ionisert Ca (ev. Na og K).
Senere kontroll av prøver på indikasjon. Ta ev. også ASAT, ALAT, kreatinin.
NB. Stoffmisbrukere kan være hepatitt B og C positive + ev. HIV positive. Sjekk mors journal nøye, få ev. tatt serologi av mor (dette bør ordnes på føden/barsel).
Rusmiddelanalyser
- Rusmiddelanalyser hos nyfødte barn gjøres i urin. Urinprøve bør generelt tas så tidlig som mulig etter fødsel ved mistanke om NAS, der man ikke vet sikkert om mor har tatt medikamenter.
- Urinprøver vil sjelden slå ut positivt hos barnet hvis mor ikke har inntatt rusmidler de siste 2–5 dager før fødselen. Negativt prøvesvar utelukker derfor naturligvis ikke et ev. maternelt rusmiddelmisbruk under svangerskapet.
- Det har liten (ingen) verdi å ta i urinprøve av barn født av mødre som er stabile under LAR.
- Prøver av mekonium ville kunne reflektere et lengre ”bruksvindu” enn urinprøvene, men er ikke tilgjengelig ved sykehus i Norge.
- Rusmiddelanalyser i diagnostisk hensikt (medisinske prøver) analyseres ved kliniske farmakologiske avdelinger. Mor skal informeres om prøvetakingen, og at denne skjer i diagnostisk hensikt jamfør rundskriv fra HDir (se referanse). Mor kan ikke motsette seg prøver tatt i diagnostisk hensikt. Prøvesvar på rusmiddelanalyser fra Klinisk farmakologisk avdeling kan ikke alene danne grunnlag for iverksettelse av alvorlige sanksjoner mot mor (f.eks omsorgsovertakelse). Urinprøve tatt i henhold til Divisjon for rettstoksikologi og rusmiddelforskning, Nasjonalt folkehelseinstitutt sine anbefalinger (prøvekit og rekvisisjoner) forutsetter informert samtykke fra mor. Dette er imidlertid sjelden aktuelt da det ikke er prøvesvar alene som er avgjørende i en omsorgssituasjon.
Skåring
Barna skal skåres ved hjelp av modifisert Finnegan skår/NAS skår. Internasjonalt går dette skjemaet både under navnet ‘modified Finnegan score’ samt ‘NAS-score’. Det er også hensiktsmessig å bruke døgnklokke for å visualisere hvordan barnet har det.
Barna skåres kontinuerlig i 3 timer mellom hvert stell og skår summeres opp etter hvert stell. Det betyr at et barn som f.eks. gulper mye og har problemer med å sovne som våkner igjen etter en time og nyser, får skår for alle symptomene selv om det er en times søvn imellom.
Andre undersøkelser
Evt. EEG (ved kramper/uttalt CNS irritabilitet) og UL caput.
Behandling og oppfølging
NB. Barnet skal ikke ha nalokson rett etter fødsel! Den nyfødte er under svangerskapet tilvendt opioider og har opparbeidet toleranse. Hvis den nyfødte gis nalokson, kan det utløse svært voldsomme og smertefulle abstinenser. Den nyfødtes respirasjon må sikres på annen måte. Hvis mor har vært i LAR bør innleggelsen av den nyfødte på barselavdelingen vare minimum syv døgn slik at man kan være sikker på at behandlingskrevende NAS oppdages, og slik at nødvendig samarbeid med og rundt familien kan etableres. Utskrivning etter syv døgn vil kun være aktuelt der barnet ikke behandles medikamentelt for NAS.
Ikke medikamentell behandling:
- Barnet svøpes godt inn. Ro, dempet belysning, lite stimuli/sanseinntrykk.
- Hyppige måltider (7–8/døgn), ev. tilsette ekstra kalorier. Gi barnet smokk.
- Amming: Hvis mor er HIV-negativ og det ikke er pågående aktiv rusbruk vil mødre vanligvis kunne amme. Mødre som gjennomfører LAR med metadon/buprenorfin anbefales å amme hvis det ikke foreligger andre kontraindikasjoner. Ellers individuell vurdering. Sjekk i Norsk Legemiddelhåndbok under kapittel ”Amming og legemidler” og/eller spesiallitteratur/RELIS. Felleskatalogen kan ikke benyttes da den fraråder nærmest alle medikamenter under amming uten at det er tatt hensyn til ev. behov/grad av fare.
Medikamentell behandling:
- Startes ved 3 skår > 8 eller 2 skår > 12. Det skal gå en time mellom hver skåring ved verdier > 8 fram til skår synker eller medikamentelle tiltak iverksettes (se skåringsskjema).
- Trappes opp under nøye overvåking med dokumentasjon av symptomer på skåringsskjema.
Opioider
Morfin mikstur er førstevalg ved opioid-abstinens (kan også brukes ved annen abstinens).
De aller fleste barna med NAS klarer seg med monoterapi i adekvate doser. Be apoteket lage morfin mikstur 0.5 mg/ml. Oramorph® 2 mg/ml kan også benyttes, men ved lave doser under nedtrapping kan det bli vanskelig å dosere.
Dosering: Start med 0.07 mg/kg x 6. Ved manglende kontroll på symptomer trappes dosen opp til 0.1 mg/kg x 6. Dosen kan trappes ytterligere opp til man oppnår kontroll på symptomer. Ved doser over 0.2 mg/kg x 6 bør man vurdere tilleggsbehandling med annet medikament (se under). Når barnet har vært stabil i 2 døgn startes nedtrapping med 10 % dosereduksjon (av maks dosen morfin) hvert 3. døgn. Nedtrapping kan ta 1–6 uker. Morfin seponeres når dosen er 0.15 mg/kg/døgn.
NB barnet skal overvåkes tett de første dagene under morfinbehandling inkl. apnemonitorering. Overdosering kan medføre tretthet, overfladisk respirasjon, utspilt buk og forstoppelse.
Metadon og buprenorfin kan være alternativer til morfin behandling, men det foreligger i 2021 ingen sterk grunn til å endre det etablerte behandlingsregimet med morfin mikstur.
Tilleggsbehandling med ikke-opioider
De to mest brukte alternativer er fenobarbital og klonidin. Det er få studier som har sammenlignet effekt av disse, og litt sprikende resultater.
Klonidin kan ha en mere spesifikk effekt ved opioid-abstinens, og vil derfor av noen fortrekkes ved NAS etter LAR.
Hvis barnet har abstinens pga et mere «blandingsmisbruk» eller misbruk av ikke-opioider er fenobarbital med en noe bredere sederende effekt oftest anbefalt. Fenobarbital er også førstevalg ved abstinenser i forbindelse med misbruk av ikke-opioider.
Klonidin (mikstur 10 mikrogram/ml)
Forslag til dosering: Starte med 1 mikrogram/kg x 4 (døgndose 4 mikrogram/kg).
Ved manglende kontroll på symptomer trappes døgndosen opp hver 24. time:
- 1,5 mikrogram/kg x 4
- 2 mikrogram/kg x 4
- 2,5 mikrogram/kg x 4
- Max 3 mikrogram/kg x 4
Blodtrykket bør måles før oppstart og ved hver økning. Hvis systolisk BT < 60 mm Hg, skal man avvente videre opptrapping.
Hvis behov for behandling med klonidin > 5 dager er det risiko for rebound symptomer som svetting, takykardi, hypertensjon og agitasjon ved plutselig seponering. Vanligvis seponeres morfin behandling først. Når barnet er stabilt med lave NAS-skår verdier kan nedtrapping og seponering av klonidin skje etter følgende mal:
- Klonidinbruk < 5 dager: Dosen kan seponeres uten nedtrapping. Ved behov kan dosen halveres før seponering
- Klonidinbruk 5-28 dager: Reduser dosen med inntil 50 % hver dag over 3-4 dager og seponer
- Klonidinbruk > 4 uker: Reduser dosen med inntil 50 % hver 2. dag over 7 dager og seponer
Fenobarbital (mikstur 5 mg/ml)
- Ladningsdose: 10–15 mg/kg fordelt på 2 doser per os (ev. i.v)
- Vedlikeholdsdose: 3–6 mg/kg/døgn.
Ved kontroll av symptomer kan fenobarbital trappes ned med ca 10 % (av maks dosen) per døgn over 10 dager. Husk at fenobarbital demper CNS irritabilitet/virker mot kramper, men har liten effekt på GIT-symptomer ved opioid abstinens.
”Forsinket abstinens syndrom”/rusrelatert funksjonsforstyrrelse: Lett irritabilitet, søvn- forstyrrelse og tremor kan prege barn i lengre tid. Dette er ikke indikasjon for langvarig behandling.
Premature barn med NAS
Det er kjent at mødre i LAR oftere føder prematurt, dette gjelder i større grad de som behandles med metadon enn de som behandles med buprenorfin. Det er vanskeligere å skåre premature pga overlapp av symptomer relatert til prematuritet og symptomer relatert til NAS. Det finnes ingen skårings-skjemaer spesielt for premature, selv om dette etterlyses i litteraturen. I praksis betyr dette at de premature skal skåres på samme måte som terminfødte barn. Det må forventes samme grad av NAS utvikling hos de premature, og behandling er minst like viktig i denne populasjonen og må ikke holdes tilbake pga gestasjonsalder. Klonidin brukes lite i den premature populasjonen for øvrig, men er beskrevet brukt ved indikasjonen NAS, og vil kanskje være et bedre egnet medikament enn fenobarbital mtp bivirkningsprofil ved behov for tilleggsmedikasjon. Da doseringene for både morfin og klonidin er per kg kroppsvekt skal de samme doseringene brukes for premature som for terminfødte. Obs hypotensjon ved bruk av klonidin til premature.
Annen oppfølging
Mor skal behandles med respekt og man må vise hensyn overfor sårbare foreldre. Mor/foreldrene skal inkluderes og informeres om utredning og tiltak. Det bør alltid være en tverrfaglig diskusjon med involvert personell (f.eks helsesykepleier, jordmor, sykepleier, barnepleier, sosionom og lege) som kjenner mor/foreldrene til barnet. Svært viktig med anamnestiske opplysninger om svangerskapskontroll/ oppfølging, ev. jevnlig levering av urinprøver osv. Bekymringsmelding til barnevernet bør alltid sendes tidlig hvis det har vært rusmisbruk under svangerskap eller hvis man er i tvil om mor/ foreldrene kan ha omsorg for barnet. Se ellers Nasjonal retningslinje for gravide i LAR og oppfølging av familiene frem til barnet når skolealder.
Referanser
- Jansson LM, et al. Neonatal Abstinence Syndrome. Pediatr Clin North Am 2019; 66: 353–67
- Brusseau C, et al. Clonidine versus phenobarbital as adjunctive therapy for neonatal abstinence syndrome. J
- Perinatol 2020; 40: 1050-5
- Surran, B, et al. Disher T et al. Pharmacologial Treatments for Neonatal Abstinence Syndrome. A Systematic Review and Network Meta-analysis. JAMA Pediatrics. 2019;173(3):234-243.
- Mangat AK et al. Pharmacological and Non-pharmacological treatment for the Neonatal Abstinence Syndrome (NAS). Semin Fetal Neonatal Med 2019 Apr;24(2):133-141.
- Alocco E et al. Comparison of neonatal abstinence syndrome manifestations in preterm versus term opioid-exposed infants. Adv. Neonatal Care 2016; 16: 329-336.
- Kraft WK et al. Neonatal abstinence syndrome: Pharmacologic strategies for the mother and infant. Semin Perinatol 2016; 40:203-12.
- Surran B, et al. Efficacy of clonidine versus phenobarbital in reducing neonatal morphine sulfate therapy days for neonatal abstinence syndrome. A prospective randomized clinical trial. J Perinatol 2013; 33, 954–9
- Hudak ML et al. (AAP) Neonatal Drug Withdrawal. Pediatrics 2012; 129: e540-60
- Backes CH et al. Neonatal abstinence syndrome: transitioning methadone-treated infants from an inpatient to an outpatient setting. J Perinatol. 2012; 32: 425-30.
- Nasjonal retningslinje for gravide i legemiddelassistert rehabilitering (LAR) og oppfølging av familiene frem til barnet når skolealder, Helsedirektoratet, 2019. https://www.helsedirektoratet.no/retningslinjer/gravide-i-lar (søkedato: 09.10.19)
- Prosedyrer for rusmiddeltesting. Helsedirektoratet. 11/2014. ISBN-nr. 978-82-8081-335-0.
- Clonidine Newborn use only, 2020. Australasian Neonatal Medicines Formulary
- https://www.seslhd.health.nsw.gov.au/sites/default/files/groups/Royal_Hospital_for_Women/Neonatal/Neomed/neomed20clonidabb.pdf
Andre medikamenter som kan påvirke foster og det nyfødte barn (primært antidepressiva og antipsykotika)
Antidepressiva
Selektive serotonin-reopptakshemmere (SSRI) er den mest brukte medikamentgruppen av antidepressiva, også hos gravide. I Norge bruker ca 2 % av alle gravide antidepressiva i løpet av svangerskapet. SSRI synes å være relativt trygt. Det er sett en svak sammenheng mellom bruk av paroksetin (Seroxat®) og hjertefeil, men ingen andre sammenhenger mellom SSRI og føtale malformasjoner. Hvis mor har brukt SSRI-medikamenter i siste trimester av svangerskapet vil imidlertid opptil 20–30 % av de nyfødte barna få symptomer i form av:
- Skjelvinger, irritabilitet, økt muskeltonus, økt skriking, søvnforstyrrelse, rask pust
- Sjeldnere slapphet og kramper
Symptomer oppstår vanligvis ila de første 48 timer etter fødsel og går spontant over. Det er usikkert om det er abstinens eller direkte SSRI-toksisitet/effekt. Symptomene kan minne om de man ser ved NAS, men er oftest mye mildere enn ved NAS etter opioider. Det er rapportert en marginalt økt risiko for pulmonal hypertensjon (PPHN) i epidemiologiske studier, men av usikker klinisk betydning.
Hvis en kvinne bruker et SSRI i svangerskapet og er ”velkontrollert” vil man vanligvis ikke anbefale å bytte SSRI eller trappe ned, pga fare for tilbakefall av depresjon. Dette gjelder kanskje spesielt etter fødsel når det er økt fare for post partum depresjon.
Anbefalinger om oppfølging av barnet og amming:
- En kvinne som bruker antidepressiva skal følges opp under svangerskapet av lege og jordmor.
- Kvinnen kan føde på sykehus uten barneavdeling, men barnet skal observeres i minst 48 timer på barselavdeling etter fødsel (ev. symptomer ses de første 2 døgn og er vanligvis milde). Pulsoksymetriscreening gjennomføres etter rutine.
- Ved ev. uttalte NAS-lignende symptomer kontaktes barnelege.
- Kvinnen kan vanligvis amme. Blant SSRI er sertralin (Zoloft®) et gunstig valg da det i liten grad går over i morsmelk og gir ikke-detekterbare konsentrasjoner i barnets plasma. Andre SSRI går over i brystmelk i noe større grad. Overgangen til brystmelk er størst for fluoksetin (Fontex®) som har lang halveringstid og er eneste SSRI som ofte frarådes under amming. Hvis bruk av fluoksetin og barnet har symptomer bør man vurdere reduksjon av dose eller overgang til annet SSRI, i samråd med mor sin behandlende lege.
Antipsykotika
Selv om mange kvinner som bruker antipsykotika planlegger, eller blir spontant gravide, er det ingen antipsykotika som er godkjent for bruk under svangerskap. Dette er dilemma for de som behandler kvinnen; man må balansere risiko for kvinnens (mentale) helse med risiko for det ufødte barnet. Noen typer medikamenter (valproat og litium) er teratogene og bør/skal unngås brukt under graviditet. Bivirkninger av andre antipsykotika på foster og det nyfødte barnet er i mindre grad kjent.
Referanser
- Veileder i Fødselshjelp 2020. Mental helse i svangerskapet (inkl. omtale av antidepressiva)
https://www.legeforeningen.no/foreningsledd/fagmed/norsk-gynekologisk-forening/veiledere/veileder-i-fodselshjelp/mental-helse-i-svangerskapet/ - Koren G, Nordeng H. Antidepressant use during pregnancy: the benefit-risk ratio. Am J Obstet Gynecol 2012; 207: 157-63.
- Nordeng H et al. Pregnancy outcome after exposure to antidepressants and the role of maternal depression: results from the NMCC Study. J Clin Psychopharmacol. 2012; 32: 186-94.
- Petersen I, et al. Risks and benefits of psychotropic medication in pregnancy: cohort studies based on UK electronic primary care health records. Health Technol Assess. 2016; 20: 1-176
- Tran H, Robb AS. SSRI use during pregnancy. Semin Perinatol 2015; 39: 545-7
- Sie SD et al. Maternal use of SSRIs, SNRIs and NaSSAs: practical recommendations during pregnancy and lactation. Arch Dis Child Fetal Neonatal Ed 2012; 97: F472–6
- Huybrechts KF. Antidepressant use late in pregnancy and risk of persistent pulmonary hypertension of the newborn. JAMA. 2015; 313: 2142-51.
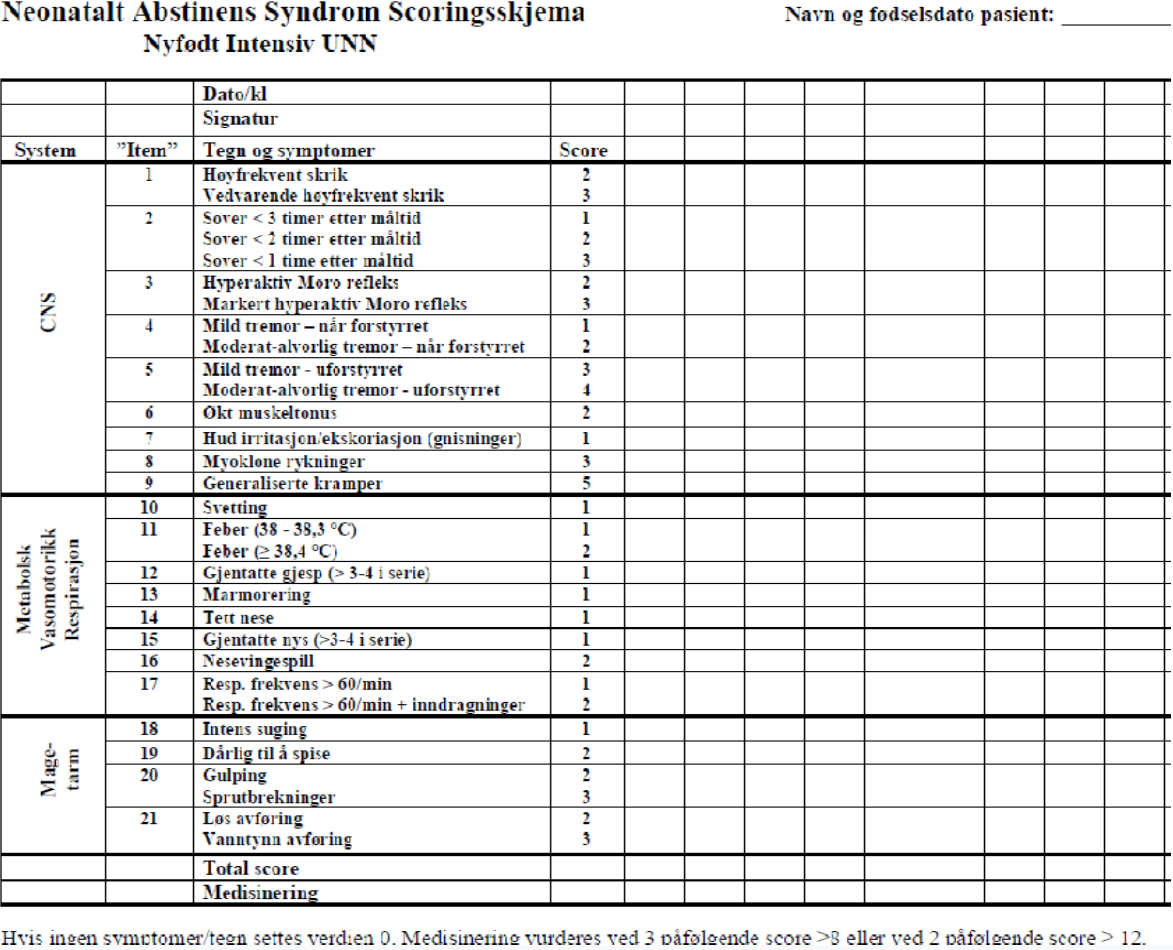
Veileder til Neonatalt Abstinens Syndrom Scoringsskjema
Scoringsskjemaet er et ”modifisert Finnegan skjema” utarbeidet på bakgrunn av referansene angitt. Barnet scores minimum 3 ganger i døgnet. Dette skal gjøres av personalet (helst to), og ikke av foreldrene. Foreldrene kan gjerne være med i scoringen, men den skal utføres av personalet. Barnet observeres i avdelingen mellom to stell og scores før neste måltid.
Høyfrekvent skrik: Høyt, iltert skrik
Vedvarende høyfrekvent skrik: Vedvarende høyt, iltert skrik. Utrøstelig. Vedvarende skrik på grunn av sult gir ikke skår.
Søvn: Lengden på ”kvalitetssøvn” etter siste mat. Hyppige oppvåkninger mellom måltider gir høyere skår.
Tremor: Alt fra små sitringer til alvorlige kramper. Det skilles på om tremor blir utløst av forstyrrelser eller om de er der konstant.
Hudirritasjon: Barnet ligger og beveger seg i sengen. Får irritasjoner i huden (ofte knær, albuer og ev hofter) på grunn av gnisninger mot underlaget. Spesifiser i notat/rapport hvor gnisningene er lokalisert.
Muskeltonus: Har barnet økt muskeltonus? Bøy og strekk i armer og bein for å kjenne på tonus. Myoklone rykninger er korte, ufrivillige rykninger av en muskel eller muskelgruppe. Generaliserte kramper skal alltid behandles medikamentelt.
Svetting: Kaldsvett, klamt barn.
Feber: Barnet har feber til tross for at infeksjon er utelukket og at barnet ikke er for godt innpakket.
Gjesping/nysing: Barnet gjesper og/eller nyser i serier på flere enn 3–4 ganger.
Respirasjon: Tell respirasjon og se på respirasjonsarbeidet. Strever barnet? Har det nesevingespill eller virker nesen tett uten sekret?
Marmorering: Marmorert i huden uten at det er en reaksjon på ytre stimuli.
Mage/tarm: Barnet er intens sugelysten utenom sult. Tiltross for stor sugelyst er barnet dårlig til å ta til seg mat. Kan gulpe mer enn vanlig og ha sprutbrekninger. Avføringen er løs og hyppig. Kan være av ”eksplosiv” art.
- Kuschel C. Managing drug withdrawl in the newborn infant. Sem Fet Neonat Med 2007; 12: 127-33.
- Hudak ML et al. Neonatal Drug Withdrawal. Pediatrics 2012; 129: e540-60.
- Finnegan LP et al. Neonatal abstinence syndrome: assessment and management. Addict Dis 1975; 2: 141–158.










