Nyfødtveileder
9 Nevrologi, sanser og mishandling
9.6 Posthemoragisk ventrikkeldilatasjon
Sist faglig oppdatert: 19.04.2023
Claus Klingenberg, Lene Nymo Trulsen, Karen Rosendahl, Hallvard Reigstad, Hans Jørgen Guthe, Ruby Mahesparan, Tone Nordvik, Jarle Sundseth, Siw Helen Westby Eger og Ragnhild Støen
Bakgrunn
Posthemoragisk ventrikkeldilatasjon (PHVD) er en progressiv utvidelse av ventrikkelsystemet som ses hos opptil 40–50 % av premature barn som har hatt en alvorlig hjerneblødning.
- Ventrikulær indeks (VI), målt med ultralyd, brukes som viktigste mål på dilatasjon av ventrikkelsystemet. Diagnosen PHVD er ofte definert av en VI > 97p for gestasjonsalder.
- PHVD kan enten være forbigående eller progrediere til en permanent hydrocefalus.
PHVD er assosiert med dårligere nevrologisk utkomme. Man antar det skyldes en kombinasjon av den primære hjerneblødningen (spesielt blødning i parenkymet), utvidelse av ventrikkelsystemet med trykk mot essensielle strukturer, og blod/nedbrytningsprodukter av blod som kan persistere i mange uker etter den primære blødning.
Ventrikulomegali (hydrocefalus ex vacuo) er en tilstand med utvidede ventrikler pga atrofi og en differensialdiagnose til PHVD. Ved denne tilstanden er imidlertid ventrikkelsystemet vanligvis ikke avrundet, utvidelsen skjer langsomt og hodeomkretsen (HO) er normal, ev. liten. Ventrikulomegali ses ofte etter hvit substans skade hos premature. Omtales ikke nærmere her.
Symptomer og funn
- Etter en alvorlig hjerneblødning hos premature barn vil ofte ventrikkelsystemet utvides etter 7–14 dagers alder, men tidspunktet for når dette oppstår kan variere.
- Denne utvidelsen kan skje raskt (~1/3) eller mere langsomt (~2/3).
- Siden suturene er åpne vil HO øke før man får andre kliniske symptomer (se under klinisk vurdering). NB. Hos premature vil økende trykk medføre kompresjon av hjerne-mantelen før man ser suturdiastase og HO økning, og det er dårlig korrelasjon mellom UL-påvisning av dilatert ventrikkelsystem og HO økning.
Diagnostikk og utredning
Klinisk vurdering
- Patologisk økning av HO
- Normalt øker HO ca 1 mm/døgn fra uke 26–32 og ca 0,7 mm/d fra uke 32 til termin.
- En økning på > 2 mm/d eller > 1,5 cm/uke anses som patologisk.
- HO bør måles hver 2. dag ved risiko for patologisk HO økning. Verdier føres på percentilskjema.
- Spent/stor fontanelle og suturdiastase > 2–3 mm
- Irritabilitet, apne, oppkast (sent).
Ultralyd caput
Ved begynnende PHVD bør UL utføres 2–3 ganger i uken.
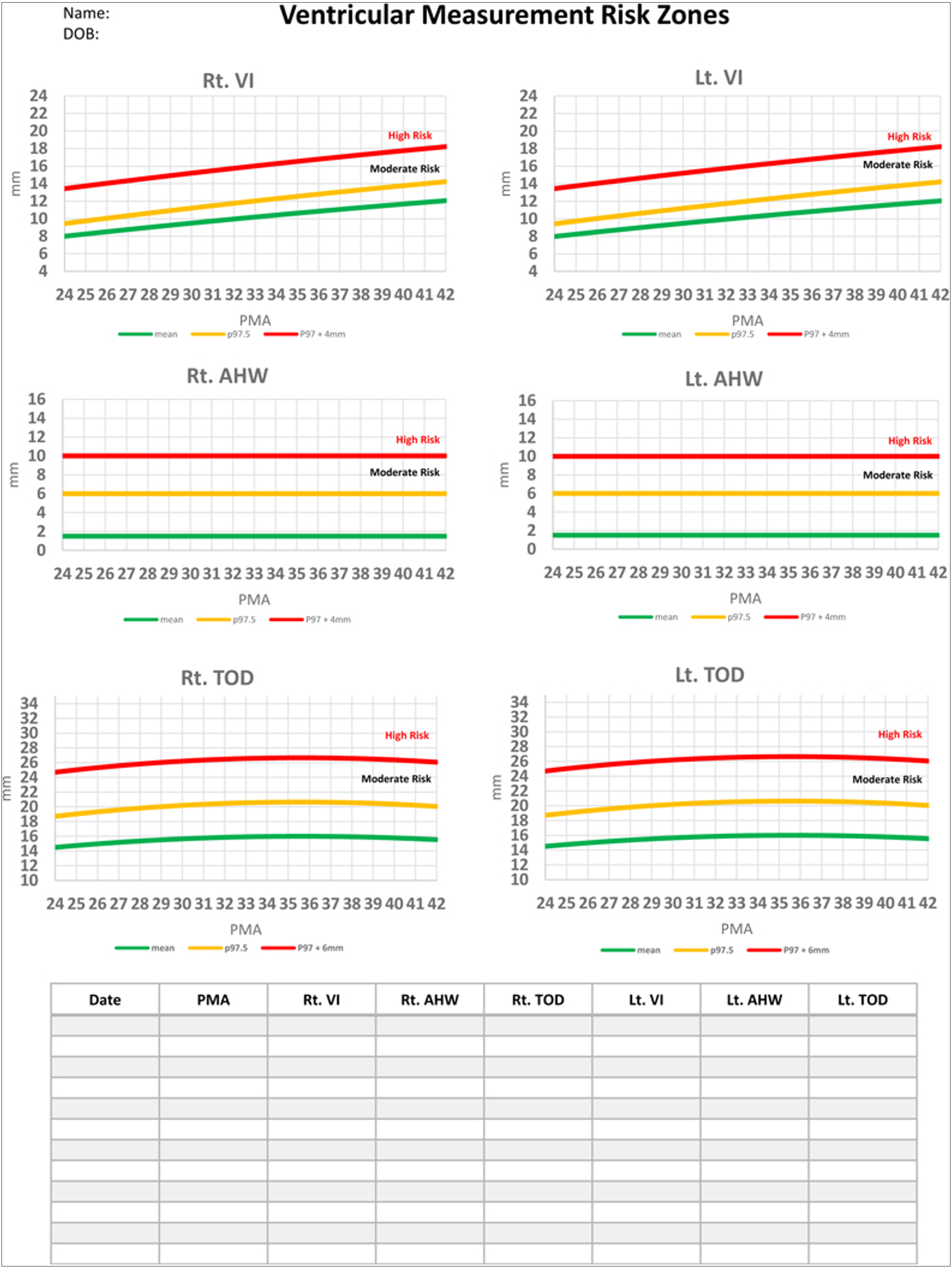
Man skal alltid måle i) ventrikulær indeks (VI) og ii) dybden på frontalhorn (AHWD). Disse to målene har best inter- og intra-observer pålitelighet. Ev. også måle talamo-occipital avstand (TOD) og bredden på 3. ventrikkel. Se egne percentil kjema, som også ligger i Neonatalprogrammet, for vurdering av VI, AHWD og TOD.
Ved unilateral porencefal cyste gjøres skjønnsmessig vurdering om det er riktigere å måle VI på kontralaterale side
- Ventrikulær (Levene) indeks (VI) er avstanden fra midtlinjen og til ytre laterale grense av sideventrikkelen målt i coronalplan i nivå med 3. ventrikkel/foramen Monroi. VI er validert i en rekke studier.
- Dybden på frontale horn (anterior horn width -AHW) måles i samme bilde som VI og er et annet godt validert mål på ventrikkeldilatasjon.
- Thalamo-occipital avstand (distance) – TOD er også et mål på ventrikkeldilatasjon. TOD er mindre standardisert/lettere å måle feil enn VI og AHW.
- Bredden til tredje ventrikkel (patologisk hvis ≥ 3 mm)
- En morfologisk vurdering er også viktig. Avrundet/ballonert ventrikkelsystem indikerer økt trykk. Hvis det samtidig ikke er synlige subaraknoidalrom støtter dette diagnosen. Romslige subaraknoidalrom taler derimot mer i retning atrofi.
- Gjentatte målinger av resistiv indeks (RI) og bruk av NIRS kan gi tilleggsinformasjon om påvirket cerebral hemodynamikk/perfusjon. Ved økende PHVD ser man ved RI-måling en økning i systolisk flow, men gradvis fallende diastolisk flow som kan gå mot null eller bli negativ.
Behandling og oppfølging
En stor europeisk studie (ELVIS-studien) ga holdepunkter for noe bedre prognose hvis man starter behandling tidlig, dvs. når barnet har utviklet PHVD med VI > 97p sammenlignet med tidligere anbefaling om å vente med behandling til VI er ≥ 4 mm > 97p. ELVIS-studien er bakgrunn for anbefalingene i dette avsnittet.
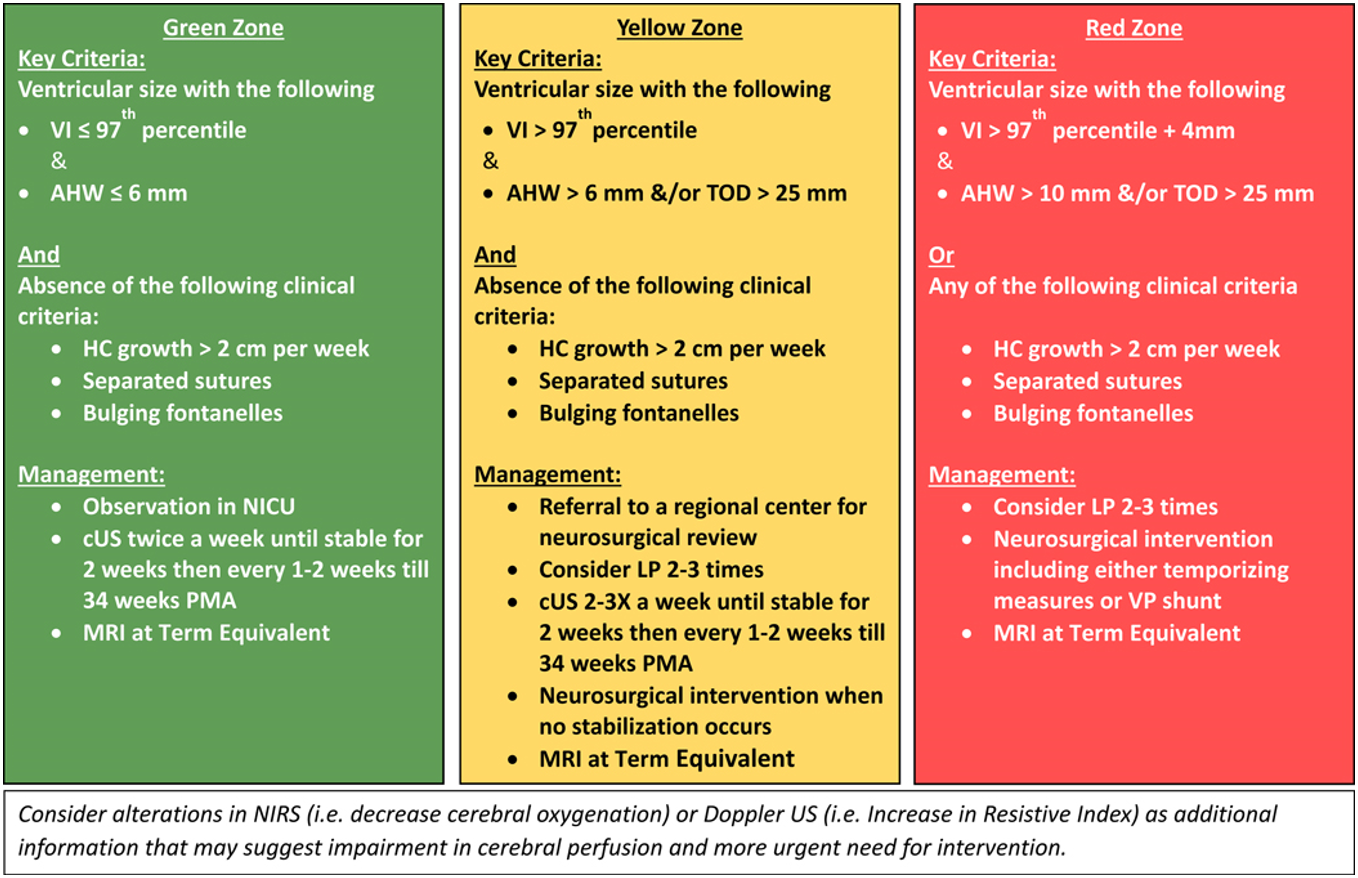
Se skjemaer der verdier for VI, AHW og TOD er angitt i henhold til gestasjonsalder og Figur med «Key criteria» for behandling i henhold til grønne, gule og røde linjer.
- Behandling kan starte med CSF-tapping via spinalpunksjon når VI > 97p og AHW > 6 mm eller TOD > 25 mm (over gul linje).
- Behandling bør senest starte når VI er ≥ 4 mm > 97p og AHW > 10 mm (over rød linje).
Spinalpunksjon og CSF tapping
- Tapp ca. 10 ml CSF/kg over 10–20 min (hastighet omtrent 1 ml/kg per minutt)
- Hvis VI/AHW øker til over ”gul linje” gjentas spinalpunksjon ytterligere 1–2 ganger med noen dagers mellomrom.
- Hos noen barn er dette tilstrekkelig, og det blir ikke behov for ytterligere intervensjon. Barna må følges med UL (2–3 ganger i uken) til man ser at det er en stabil situasjon.
Hvis tapping med spinalpunksjon (2–3 ganger) ikke stabiliserer situasjonen, vil det være indisert å anlegge i) ventrikkel reservoar eller ii) ventrikulær subgaleal shunt (VSGS) for fast, regelmessig tapping inntil barnet er stort nok til å få anlagt en permanent shunt.
- Begge alternativ har ulike fordeler/ulemper (se ref. 3), men aneses som likeverdige. Valg av metode er lokal preferanse.
- Kontakt med nevrokirurg i forkant opprettes i tråd med lokale prosedyrer
- All videre behandling skjer i tett samarbeid mellom nyfødtlege og nevrokirurg.
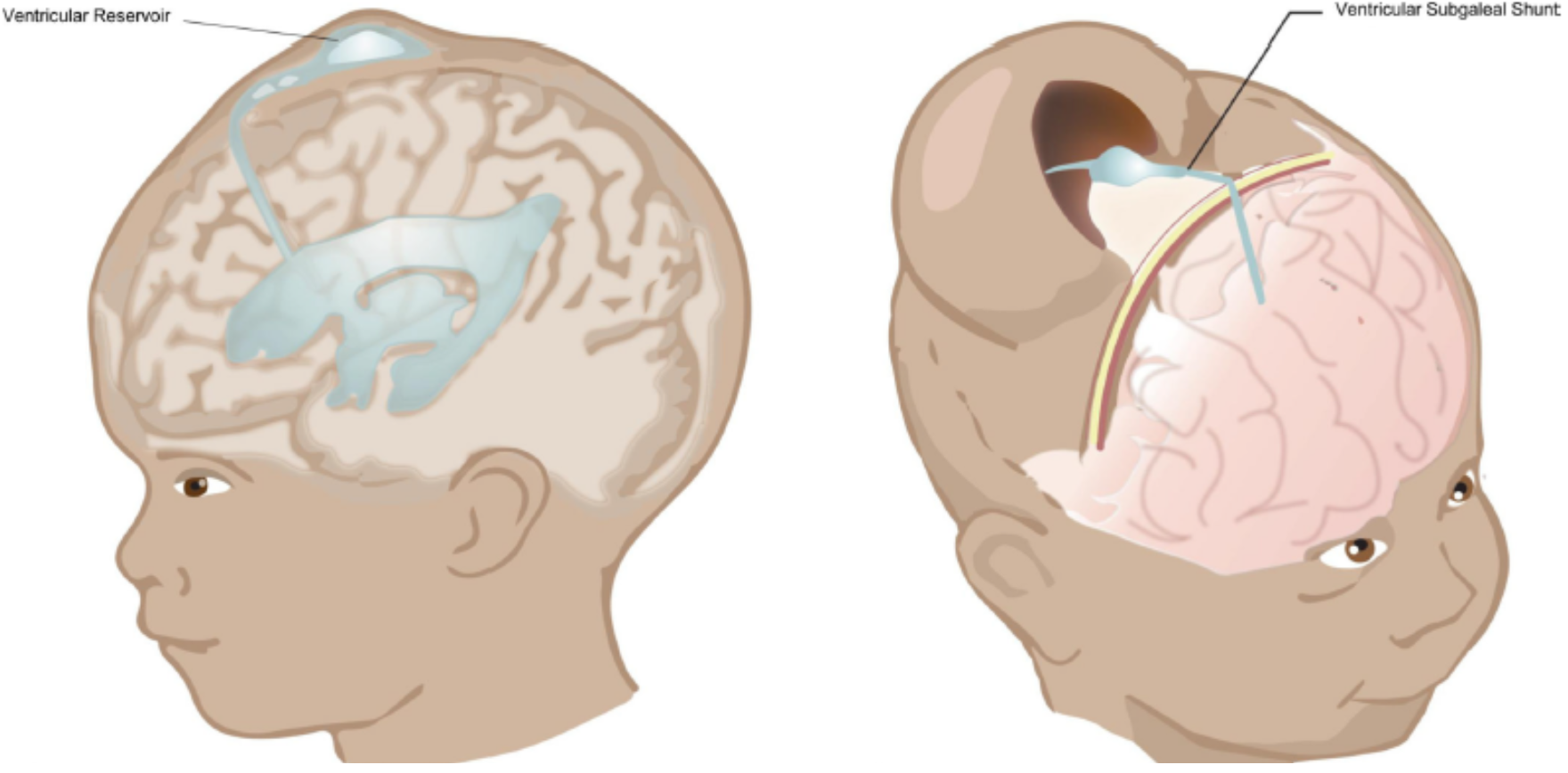
Ventrikkel (Ommaya) reservoar
- Innlegging av Ommaya reservoar er et ”lite inngrep”, men vi anbefaler antibiotika-profylakse.
- I forbindelse med innlegging av reservoaret tappes max 20 ml/kg spinalvæske over 10–20 min.
- De første dager etter innsetting av reservoaret er det viktig å unngå høyt trykk som kan gi lekkasje og risiko for infeksjon. Derfor skal det de første 5 dager alltid tappes rundt 10 ml/kg/d.
- Etter de første 5 dager må volum og hyppighet av tapping styres av HO tilvekst og UL målinger.
Målet med tapping er at man innen 7–10 dager etter innsetting av reservoaret har fått redusert VI < 97p (under gul linje).- Man tapper rundt 10 ml/kg. Hastighet max 1 ml/kg per minutt per enkelt-tapping.
- Hvis det over tid er behov for tapping av mer enn 10 ml/kg for å holde VI < 97p er det bedre å tappe to ganger daglig.
- I noen tilfeller (10–40 %) vil den ventrikulære dilatasjonen avta/stoppe og det blir ikke en permanent shunt-krevende hydrocefalus. Man kan da fjerne reservoaret etter at man har fulgt barnet med UL og HO tilvekst over flere uker og fått bekreftet at hodet vokser normalt, eller alternativt la det ligge.
Ventrikulær subgaleal shunt (VSGS)
Anleggelse av en VSGS er også et ”lite inngrep”. Det anlegges et kateter i frontalhornet som plasseres i en ”lomme” som man lager i det subgaleale rommet. Lommen må være stor nok til at det er nok overflate i det subgaleale rommet til å reabsorbere CSF. En velfungerende VSGS vil kunne drenere CSF kontinuerlig uten behov for tapping. Den subgaleale lommen kan blir relativt stor og noen ganger virke kosmetisk ”skjemmende”.
Shuntkirurgi
Hvis fortsatt behov for regelmessig tapping fra reservoar/drenasje fra VSGS og vekt > 2,0–2,5 kg vurderes innsetting av ventrikuloperitoneal (VP) shunt. Før innsetting av VP shunt bør vanligvis CSF protein nivået være < 1,5 g/l
Annet
- Behandling med diuretika er ikke indisert
- Behandling i henhold til DRIFT-studien (ref 9–11) er ikke angitt som rutine i nyere litteratur.
- En del eksperter anbefaler MR ved termin alder av alle barn som er behandlet for PHVD.
Referanser
- Cizmeci MN, et al. Assessment of Brain Injury and Brain Volumes after Posthemorrhagic Ventricular Dilatation: A Nested Substudy of the Randomized Controlled ELVIS Trial. J Pediatr. 2019; 208: 191-7
- Cizmeci MN, et al. Randomized Controlled Early versus Late Ventricular Intervention Study in Posthemorrhagic Ventricular Dilatation: Outcome at 2 Years. J Pediatr. 2020; 226: 28-35.e3
- El-Dib M, et al. Management of Post-hemorrhagic Ventricular Dilatation in the Preterm Infant. J Pediatr 2020; 226:16-27
- Limbrick DD, et al. New insights into the management of posthemorrhagic Hydrocephalus. Sem Perinatol 2022; 46: 151597
- Levene M. Measurement of the growth of the lateral ventricle in preterm infants with real-time ultrasound. Arch Dis Child. 1981; 56: 900-904
- Davies MW, et al. Reference ranges for linear dimensions of intracranial ventricles in preterm neonates. Arch Dis Child Fetal Neonatal Ed. 2000; 82: F218 –F223.
- Sondhi et al. Establishment of nomograms and reference ranges for intra-cranial ventricular dimensions and ventriculo-hemispheric ratio in newborns by ultrasonography. Acta Paediatr. 2008; 97: 738-44.
- Srinivasakumar P, et al. Posthemorrhagic ventricular dilatation-impact on early neurodevelopmental outcome. Am J Perinatol. 2013;30: 207-14.
- Whitelaw A, et al. IVH-DRIFT protocol 2014
- Whitelaw A et al. Randomized clinical trial of prevention of hydrocephalus after intraventricular hemorrhage in preterm infants: brain-washing versus tapping fluid. Pediatrics. 2007; 119: e1071-8
- Luyt K, et al. Drainage, irrigation and fibrinolytic therapy (DRIFT) for posthaemorrhagic ventricular dilatation: 10-year follow-up of a randomised controlled trial. Arch Dis Child Fetal Neonatal Ed. 2020; 105:466-73
- Eid S, et al. Ventriculosubgaleal shunting-a comprehensive review and over two-decade surgical experience. Childs Nerv Syst 2018; 34: 1639–42
- Chari A, et al. Intraventricular haemorrhage and posthaemorrhagic ventricular dilatation: moving beyond CSF diversion. Childs Nerv Syst. 2021;37:3375-83.
For nedlasting
Risk score zones GA 24-29:
https://drive.google.com/file/d/1xAHNEeGCZMjgffskVMpXMOqn2DWXq6dT/view
Risk score zones GA 24-42:
https://drive.google.com/file/d/1EiQ7wUgyhOtdqBbiZlgU-cA8lL_HQ6P_/view
Publisert 2021: Claus Klingenberg og Rune Henning










