Nyfødtveileder
4 Infeksjoner
4.1 Neonatal sepsis
Sist faglig oppdatert: 13.11.2023
Claus Klingenberg, Anne Lee Solevåg, Beate Horsberg Eriksen, Norvald Heggstad, Siv Steinsmo Ødegård, Anlaug Vatne og Anne Karin Brigtsen
Bakgrunn
- Sepsis er en viktig årsak til alvorlig sykdom og ev. død hos nyfødte generelt, og spesielt hos premature barn med umodent immunforsvar.
- Sepsis hos premature er assosiert med senskader inkl. dårligere psykomotorisk utvikling.
- Ved sepsis er tidlig antibiotikabehandling det viktigste tiltaket for økt overlevelse.
- På grunn av potensielt vage symptomer er klinisk mistanke om sepsis vanlig, noe som kan føre til overbehandling med antibiotika.
Tre hovedgrupper av neonatal sepsis (alder 0–28 dager/PMA opp til 44 uker).
- Tidlig (early-onset) sepsis; EOS: Infeksjon første 3 levedøgn (0–72 levetimer), forekommer både hos fullbårne og premature. Vanligste mikrober er gruppe B streptokokker (GBS) og E. coli (spesielt hos små premature). Andre Gram-negative bakterier, viridans gruppe streptokokker (VGS) og ev. Listeria forekommer også.
- Sen (late-onset) sepsis; LOS, oppstått under innleggelse på sykehus: Infeksjon etter 72 levetimer. Økt forekomst hos premature. Hyppigste mikrober er koagulase negative stafylokokker (KNS), S. aureus og Gram-negative bakterier. Kan også være LOS-GBS. Obs. candida infeksjoner.
- Sen (late-onset) sepsis hos nyfødte barn som innlegges fra hjemmet: Dette er en ganske liten gruppe, oftest fullbårne som har vært friske ved hjemreise fra barsel. Sepsis kan skyldes late-onset GBS infeksjon, urosepsis, andre alvorlige bakterielle infeksjoner eller viral infeksjon. Obs. herpes simpleks virus infeksjoner.
Diagnosen sepsis kan være vanskelig å stille, spesielt ved manglende vekst i blodkultur eller vekst av bakterier som også kan være forurensing. Det finnes i 2023 fortsatt ingen internasjonal enighet om kriterier for neonatal sepsis. I Norge er det foreslått følgende kriterier for ICD-10 diagnoser neonatal sepsis, og at disse kriterier brukes ved registering i Neonatalprogrammet:
Sepsis (P36. ):
Oppvekst av mikrober i blod og ev. spinalvæske kombinert med klinisk bilde forenlig med systemisk infeksjon.
Sepsis, men uten oppvekst i blodkultur (P36.9):
Følgende 4 kriterier skal være oppfylt:
- Klinikk forenlig med infeksjon
- CRP > 30 mg/l i forløpet (kan akseptere lavere CRP verdi hvis død av klinisk akutt sepsis innen 5 dager etter symptomdebut).
- Minst 5 dagers antibiotikabehandling, eller død av klinisk sepsis innen 5 dager etter symptomdebut.
- Utelukke annen mulig årsak.
Sepsis m/oppvekst av koagulase negative stafylokokker (P36.3)
Vekst av KNS i blodkultur (minimum en flaske) og begge tilleggskriterier:
- CRP > 10 mg/l ± 2 dager fra blodkulturen er tatt.
- Minst 5 dagers antibiotikabehandling, eller død av KNS-sepsis før 5 dager.
RISIKOFAKTORER FOR SEPSIS ER ULIKE FOR EOS OG (NOSOKOMIAL) LOS:
- EOS: Langvarig vannavgang (> 18 timer), tegn på infeksjon hos mor, GBS-bakteriuri, tidligere født et barn med GBS infeksjon. Spesielt økt infeksjonsrisiko ved prematuritet, lave Apgar skår/sykt barn rett etter fødsel og/eller hvis mor har symptomer på amnionitt (feber, øm uterus, stigende CRP/hvite).
- Nosokomial LOS: Invasiv behandling (respirator, langvarig parenteral ernæring, inneliggende kateter, postnatale steroider etc.) og alt som bryter hud-slimhinnebarrieren kan disponere for sepsis.
Symptomer og klinikk
- Fra uspesifikke symptomer som respirasjonsbesvær, apnétendens, temperaturlabilitet, gulping/aspirat, slapphet, dårlig sugeevne, irritabilitet, «sykt barn», til sirkulatorisk påvirkning ev. med lavt blodtrykk.
- På et tidlig stadium er det svært vanskelig/umulig å skille sepsis fra andre vanlige tilstander som f.eks transitorisk takypne/wet lung, hypoglykemi, RDS, asfyksi og hjerneblødning.
Diagnostikk og utredning
Mistanken om sepsis baseres på klinikk, men vurderes også i lys av risikofaktorer og ev. foreliggende laboratorieprøver. Ved relativt lav mistanke om sepsis, vil regelmessig klinisk observasjon være nyttig for å unngå overbehandling med antibiotika. Hvis ingen progresjon i symptomer eller symptomer avtar/går spontant tilbake er det liten risiko for at det er sepsis.
Infeksjonsstatus (før oppstart antibiotika)
- Alltid blodkultur før antibiotika
- Hb, hvite m/diff, trc, CRP. Ev. PCT, ev. SBS (avhengig av hva som er tatt nylig av prøver)
- Ev. spinalvæskeanalyser, urindyrkning (ikke ved tidlig sepsis) og andre dyrkningsprøver
KOMMENTARER TIL AKTUELLE PRØVER
Hematologiske variabler
Anses generelt som lite sensitive og spesifikke mtp neonatal sepsis
- Total hvite. Obs. infeksjon ved verdier < 5. Høye verdier er normalt, men mer obs. > 30.
- Nøytrofile granulocytter (obs. ved nøytrofile granulocytter < 1,5)
- Trombocytter (obs. når < 100, men man ser ofte også trombocytopeni hos SGA barn uten infeksjon, trombocytopeni er et uspesifikt funn)
Leukopeni, nøytropeni og trombocytopeni sees etter preeklampsi og HELLP syndrom hos mor, ved føtal veksthemning (FGR) samt etter asfyksi og hjerneblødning. Nøytrofili sees etter oksytocin bruk hos mor, asfyksi, traumatisk forløsning, maternell feber, postoperativt og ved mekoniumaspirasjon, erytroblastose, kramper og når det gis steroider.
Økt antall kjerneholdige røde blodceller kan gi falskt forhøyet antall hvite blodlegemer ved maskinell telling; ses etter FGR/sviktende placentafunksjon.
C-reaktivt protein (CRP)
CRP-stigning kommer først 12–24 timer etter debut av en infeksjon. Forhøyede verdier (f.eks > 30–50 mg/L) kan tale for bakteriell infeksjon, men CRP kan være normal ved sepsis i tidlig fase og forhøyede verdier kan sees hos friske ved flere ikke-infeksiøse maternelle og neonatale tilstander. Det kliniske bildet er viktigst. En vedvarende lav CRP (< 5–10 mg/L) 24–48 timer etter symptomdebut har høy negativ prediktiv verdi, dvs taler sterkt imot infeksjon. CRP kan også brukes for å monitorere respons på behandling hos de med infeksjon som får antibiotika.
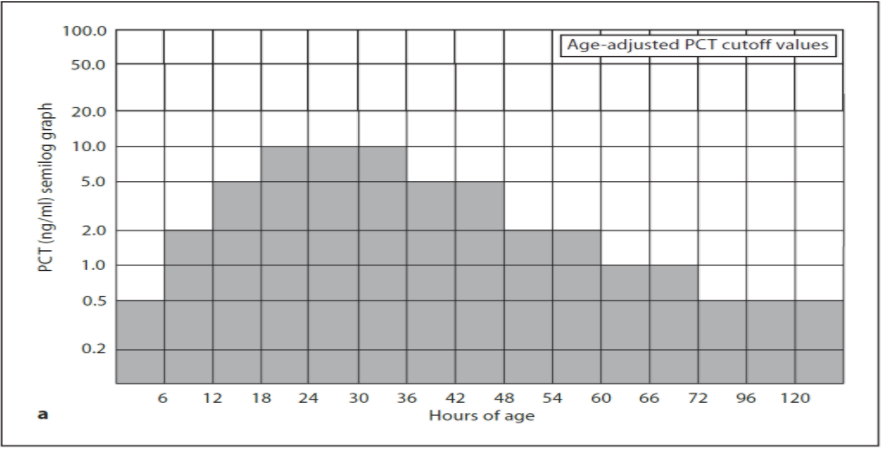
Procalcitonin (PCT)
En biokjemisk markør på bakterielle infeksjoner. PCT stiger tidligere enn CRP ved bakterielle infeksjoner, dvs. PCT har en høyere sensitivitet i diagnostikk av bakterielle infeksjoner. PCT har også høy negativ prediktiv verdi (som CRP), men er neppe bedre enn CRP til å unngå unødig antibiotikabruk. Man må være oppmerksom på at i de første 72 levetimer vil referanseområdet for PCT kontinuerlig være i endring noe som vanskeliggjør tolking av PCT ved spørsmål om tidlig sepsis. Etter første 3 levedøgn er referanseområdet stabilt.
Etter 72 timer: Verdier < 0,6–1 ng/ml taler imot sepsis, verdier > 2 ng/ml kan tale for sepsis.
Andre biomarkører på sepsis (ikke rutinemessig i bruk i Norge)
Noen steder i utlandet benyttes rutinemessig IL-6 eller IL-8.
Presepsin anses som en mulig lovende tidlig markør på neonatal sepsis.
Blodkultur
Skal alltid tas før oppstart antibiotika.
Prøvetakingsteknikk: Grundig huddesinfeksjon. Direkte teknikk (= innstikk i blodkar med vacutainernål) anbefales, men indirekte teknikk (= prøvetaking til sprøyte ved hjelp av spiss eller butterfly, deretter overføring til kulturmedium) er akseptabelt.
- Prøvetakingsvolum bør være minimum 1 ml, men send det du får selv om det er lite (hos små premature kan 0,5 ml aksepteres).
- Prøvevolum bør skrives ned på rekvisisjonen. Man vet da hvor mye som er tatt når svar vurderes. Ev. veies blodkulturflasken for å få best oversikt over volum tatt.
- Blodkultur bør gå rett i dyrkningsskap (sjekk lokale rutiner). Tid til en positiv blodkultur er for de fleste relevante bakterier under 24 timer.
Man kan også ta blodkultur fra kateter (NAK, PAK, NVK, CVK, PVK) umiddelbart etter steril innleggelse. Senere prøver tatt fra kateter er uakseptable pga. høy forurensningsrisiko. Ved mistanke om kateterassosiert infeksjon bør man likevel ta blodkultur fra kateter samt dyrkning av kateterspissen (hvis/når den fjernes) som et supplement til en obligat perifer blodkultur.
Spinalvæske til dyrkning/PCR
- Tas ved kliniske symptomer på sepsis + meningitt. Bør også tas hvis det er vekst i blodkultur av høypatogene mikrober (f.eks E. coli og GBS) kjent for også å gi meningitt.
- Man må alltid også gjøre en vurdering om barnet tåler prosedyren (ikke hos ustabile premature).
- Selv etter 2–3 dagers antibiotikabehandling kan man ta CSF til multiplex-PCR på en rekke agens; og det kan ha betydning for valg av antibiotika og behandlingsvarighet.
Urin
- Tas ved sepsisdebut uten annen kjent årsak hos fullbårne nyfødte etter 3. levedøgn.
- Ikke rutinemessig hos premature som utvikler sen sepsis under innleggelsen
Helst blærepunksjon. Alternativt steril kateterisering, clean catch eller poseurin.
Dyrkning av tubespiss/trakealsekret
Rutinemessig dyrkning av tvilsom verdi ved fravær av infeksjonssuspekte lungefunn, og man vil oftest finne kolonisering av bakterier. Kan være indisert ved mistanke om lungeinfeksjon.
Rtg. thorax:
Ikke rutinemessig ved mistanke om infeksjon/sepsis, kun på indikasjon, som for eksempel for å vurdere/utelukke andre årsaker til et ev. pustebesvær/rask respirasjon.
Behandling og oppfølging
Oppstart antibiotika
- Hovedprinsippet er å starte antibiotika så raskt som mulig når sepsis er sannsynlig og samtidig unngå unødvendig antibiotika ved tilstander som ikke er infeksiøse. Man behandler på mistanke om sepsis, primært ut i fra kliniske symptomer, men også etter vurdering av risikofaktorer og ev. biokjemiske funn. Det skal alltid være en grundig vurdering før oppstart antibiotika.
- Etter at beslutning er tatt om oppstart antibiotika bør behandling starte helst innen en time.
- Hvis det ikke er sterk mistanke og uklar klinikk anbefales regelmessig observasjon med TVS-N (på føde/barsel) eller «timesobservasjoner» (på nyfødt intensiv).
Spesielle grupper
- Svært premature barn (født før uke 32): Det er lav risiko for tidlig sepsis ved keisersnitt pga. ikke-infeksiøs sykdom hos mor eller placentasvikt, uten forutgående spontan fødselsstart eller vannavgang. Antibiotika kan da avventes til tross for respiratoriske symptomer som RDS med behov for respirasjonsstøtte. Uavhengig av risikofaktorer: Lav terskel for blodkultur og empirisk antibiotika hos alvorlig syke premature barn eller ekstremt premature barn < 26–28 uker.
- Alvorlig asfyksi: Valg av antibiotika følger hver avdeling sine rutiner. Hvis man bruker aminoglykosider bør doseringsintervall forlenges pga. ofte nedsatt nyrefunksjon.
- Barn som innlegges fra hjemmet: Alltid obs. fokus for infeksjon (f.eks UVI) og eventuelle alvorlige virale infeksjoner (f.eks HSV).
Seponere antibiotika tidlig?
- På tross av grundig klinisk vurdering før oppstart antibiotika vil det være en del barn som får antibiotika der deres symptomer ikke var forårsaket av en infeksjon, og som dermed (sett i ettertid) ikke har behov for antibiotika.
- Behandlingen seponeres helst innen 24–36 (48) timer dersom fravær av klinikk som tilsier alvorlig infeksjon (respiratorisk/sirkulatorisk stabil), ingen rapportert vekst i blodkultur, ”fredelige” infeksjonsparameter (CRP) som ikke støtter sepsisdiagnosen og/eller det foreligger andre mer sannsynlige årsaker til pasientens symptomer. CRP tatt 24–36 timer etter oppstart antibiotika kan benyttes som beslutningsstøtte for å seponere, men det er viktig å vite at moderat forhøyede verdier (> 30 mg/L) ikke alene er grunnlag for 5 dagers antibiotikabehandling hvis det ellers er fredelig klinikk og negativ blodkultur.
- Hos premature med lav risiko skal avvik i laboratorietester ikke alene føre til forlenget empirisk antibiotikabehandling. Langvarig antibiotikabehandling (> 3 dager) uten at det er påvist/verifisert en infeksjon er hos svært premature barn assosiert med økt sykelighet/dødelighet og bør unngås.
VALG AV ANTIBIOTIKA VED EMPIRISK BEHANDLING
Tidlig sepsis (0–72 timer) for både premature/fullbårne:
Penicillin G og gentamicin
Nosokomial sen sepsis (> 72 timer) hos inneliggende premature
Tre alternativer
- Cefazolin og gentamicin
- Kloxacillin og gentamicin
- Vankomycin og gentamicin
Sen sepsis (> 72 timer) hos nyfødte (ofte fullbårne barn) som har vært hjemme
- Ampicillin og gentamicin
- Ved mistanke om HSV sepsis gis også aciklovir
Bakgrunn for valg av ulike antibiotika
- Ved tidlig sepsis er det viktig med dekning mot GBS (penicillin G) og Gram-negative bakterier (gentamicin). Dette dekker også mot ev. meningitt, men hvis påvist meningitt justeres behandlingen.
- Ved sen sepsis er det viktig med dekning mot stafylokokker og GBS (cefazolin, kloksacillin eller vankomycin) og Gram-negative bakterier (gentamicin og cefazolin). Meticillinresistente KNS (MR-KNS) er vanligste årsak til sen sepsis hos små premature, særlig hvis inneliggende sentrale kateter. Studier fra Nederland viste at mange nyfødte med sen sepsis forårsaket av MR-KNS responderte godt på behandling med 1. generasjon cefalosporiner på tross av in vitro meticillin resistens. Man må derfor ikke automatisk bytte til vankomycin ved sen sepsis i slike tilfeller, med mindre det er dårlig klinisk respons. Cefazolin dekker også Gram-negative bakterier (noe vankomycin ikke gjør) og har bedre effekt på følsomme S. aureus og GBS enn vankomycin.
- Piperacillin-tazobactam eller meropenem er behandlingsalternativ ved vanskelige infeksjoner som ikke responderer på de mer vanlige antibiotika-kombinasjonene. Meropenem dekker bl.a godt mot pseudomonas og andre resistente (ESBL-produserende) Gram-negative bakterier.
- Soppinfeksjon må også vurderes!
- Antibiotikavalg justeres ev. dersom man får oppvekst, i tråd med resistensbestemmelsen.
Behandlingsvarighet/seponering av behandlingen
- Tidlig seponering hvis ikke bekreftet infeksjon, se over.
- Hvis man på bakgrunn av en grundig helhetlig vurdering (klinikk og inflammasjonsprøver) tror at et barn har neonatal sepsis, men det ikke tilkommer vekst i blodkultur, er det oftest tilstrekkelig med 5 dagers behandling.
- Ved sepsis og positiv blodkultur vil behandlingstid til en viss grad individualiseres ut i fra klinisk (og CRP) respons, men ofte varighet 7–10 dager.
Referanser
- Shane AL, et al. Neonatal sepsis. Lancet 2017;390:1770-80.
- Puopolo KM, et al. Management of Neonates Born at ≥ 35 0/7 Weeks’ Gestation With Suspected or Proven Early-Onset Bacterial Sepsis. Pediatrics. 2018; 142: e20182894
- Wynn JL, et al. Progress in the management of neonatal sepsis: the importance of a consensus definition. Pediatr Res 2018; 83:13-5.
- Cantey JB, et al. Ending the Culture of Culture-Negative Sepsis in the Neonatal ICU. Pediatrics 2017;140.
- Klingenberg C, et al. Culture-negative early-onset neonatal sepsis – at the crossroad between efficient sepsis care and antimicrobial stewardship. Front Pediatr 2018; 6: 285
- Cantey JB, et al. Reducing unnecessary antibiotic use in the neonatal intensive care unit: a prospective interrupted time-series study. Lancet Infect Dis 2016;16:1178-84.
- Stocker M, et al. Procalcitonin-guided decision making for duration of antibiotic therapy in neonates with suspected early-onset sepsis: a multicentre, randomised controlled trial (NeoPIns). Lancet 2017; 390:871-81.
- Mjelle AB, et al. Serum concentrations of C-reactive protein in healthy term-born Norwegian infants 48-72 hours after birth. Acta Paediatr. 2019; 108: 849-54
- Hofer N, et al. Non-infectious conditions and gestational age influence C-reactive protein values in newborns during the first 3 days of life. Clin Chem Lab Med 2011;49:297-302.
- Haertel C, et al. Characterisation of the host inflammatory response to Staphylococcus epidermidis in neonatal whole blood. Arch Dis Child Fetal Neonatal Ed 2008; 939: F140-5
- Wynn JL, et al. Pathophysiology and Treatment of Septic Shock in Neonates. Clin Perinatol 2010; 37: 439–79
- Krediet TG, et al. Clinical outcome of cephalothin versus vancomycin therapy in the treatment of coagulase-negative staphylococcal septicemia in neonates: relation to methicillin resistance and mec A gene carriage of blood isolates. Pediatrics 1999; 103: E29.
- Hemels MAC et al. Seven-Year Survey of Management of Coagulase-Negative Staphylococcal Sepsis in the Neonatal Intensive Care Unit: Vancomycin May Not Be Necessary as Empiric Therapy. Neonatology 2011; 100:180–5
- Huncikova Z, et al. Late-onset sepsis in very preterm infants in Norway, 2009-2018. Arch Dis Child Fetal Neonatal Ed, 2023;0: F1–F7. doi:10.1136/archdischild-2022-324977
- Vatne A, et al. Early Empirical Antibiotics and Adverse Clinical Outcomes in infants born very preterm: A population-based cohort. J Pediatr. 2023; 253:107-114.
- Giannoni E, et al. Analysis of Antibiotic Exposure and Early-Onset Neonatal Sepsis in Europe, North America, and Australia. JAMA Netw Open. 2022; 5: e2243691
- Vatne A, et al. Reduced antibiotic exposure by serial physical examinations in term neonates at risk of early-onset sepsis. Pediatr Infect Dis J. 2020; 39:438-43.
- Dretvik T, et al. Active antibiotic discontinuation in suspected but not confirmed early-onset neonatal sepsis – a quality-improvement initiative. Acta Paediatr. 2020; 109: 1125-30
- Mundal HS, et al. Sepsis and antibiotic use in term and near-term newborns - a nationwide population-based study. Pediatrics. 2021;148: e2021051339.
- Størdal EH, et al. Sepsis treatment options identified by 10-year study of microbial isolates and antibiotic susceptibility in a level-four neonatal intensive care unit. Acta Paediatr 2022; 111:519-26.
- Fursule A, et al. Duration of Antibiotic Therapy in Neonatal Gram-negative Bacterial Sepsis—10 Days Versus 14 Days: A Randomized Controlled Trial. Pediatr Infect Dis J 2022; 41: 156-60.
- Huncikova Z, et al. Variation in antibiotic consumption in very preterm infants - a 10-year population-based study. Accepted for publication J Antimicrob Chemother, November 2023
Tidligere versjoner
2021: Claus Klingenberg










